СТРУКТУРНАЯ ОРГАНИЗАЦИЯ И ФУНКЦИЯ БИОЛОГИЧЕСКИХ МЕМБРАН
Биологические мембраны — это активный молекулярный комплекс с высокоизбирательными свойствами, обеспечивающий обмен веществ и энергии с окружающей средой. В мембранах находятся специфические молекулярные насосы и каналы, с помощью которых регулируются молекулярный и ионный состав внутриклеточной среды. Помимо внешней цитоплазматической мембраны (плазмолемма) в клетках эукариотов имеются еще и внутренние мембраны, ограничивающие различные внутриклеточные компартменты (отсеки), например митохондрии, лизосомы, хлоропласты и т. д. Мембраны регулируют также обмен информацией между клетками и средой (восприятие внешних стимулов) и т. д. Мембраны различаются как по функции, так и по структуре. Однако всем им присущи следующие основные свойства:
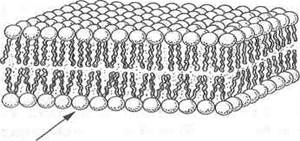
■ мембраны представляют собой плотную структуру толщиной в несколько молекул, 60-100 А, образующую сплошную перегородку между отдельными клетками и внутриклеточными отсеками;
■ мембраны главным образом состоят из липидов и белков. В мембранах имеются также углеводные компоненты, связанные с липидами и белками;
■ липиды мембран представлены относительно небольшими молекулами, несущими гидрофильные и гидрофобные группы. В водной среде эти молекулы спонтанно образуют замкнутые бимолекулярные слои, которые служат барьером для проникновения полярных соединений;
■ большинство функций мембран опосредуются специфическими белками, которые могут играть роль насосов, каналов, рецепторов, ферментов и т. д.
В состав мембран входят три основных типа липидов: фосфолипиды, гликолипиды и холестерин.
СТРОЕНИЕ МЕМБРАН
Фосфолипиды мембран. Среди липидных компонентов мембран главенствующая роль принадлежит фосфолипидам — веществам, производным либо трехатомного спирта глицерола (глицерофосфолипиды), либо более сложного спирта сфингозина (сфингофосфолипиды). Все основные глицерофосфолипиды являются производными фосфатидной кислоты, этерифицированной с гидроксильной группой спиртов, таких как серии (серинфосфатиды — кефалины), этаноламин, холин (холинфосфа-тиды), кардиолипин (дифосфатидилглицерол) и инозитол (фос-фатидилинозитол).
Из сфингофосфолипидов основным является сфингомиелин, основу которого составляет сфингозин — аминоспирт с длинной ненасыщенной углеводородной цепью. В состав сфингомиелина входит также азотистое основание холин.
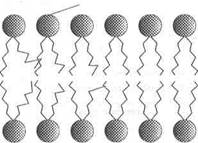
Независимо от структурных разнообразий каждая молекула фосфолипида в водной среде — это амфипатическая молекула с полярной головкой и неполярной хвостовой частью. Полярная головка образуется за счет остатков спиртовых групп, азотистых оснований и фосфорной кислоты. Хвостовая же часть - за счет радикалов двух жирных кислот насыщенного и ненасыщенного ряда. Благодаря своим амфипатическим свойствам фосфолипиды в водной среде спонтанно формируют липидные бислои, где полярные головки фосфолипидов направлены в сторону растворимой части клетки с образованием водородных связей с диполями воды, а неполярные хвосты — внутрь бислоя, скрепляясь между собой за счет гидрофобных взаимодействий. Именно бислойная структура фосфолипидов определяет полупроницаемые свойства мембран.
В качестве примера можно привести фосфатидилэтаноламин и фосфатидилхолин. Оба они имеют в верхней части молекулы полярные головки NH4 (фосфатидилэтаноламин) и N+ (фосфатидилхолин), которые через остаток фосфорной кислоты и глицерина присоединены к двум остаткам жирных кислот, из которых одна насыщенная, другая — ненасыщенная (рис. 1).
|
|
|
|
|
|
|
Фосфолипиды с ненасыщенными жирными кислотами |
Фосфолипиды с насыщенными жирными кислотами |
В 1972 г. С. Дж. Сингер и Г. Никольсон сформулировали теорию строения мембран, согласно которой мембраны имеют жидкостно-мозаичную структуру. При обычной для клетки температуре мембранный бислой находится в жидком состоянии, что обеспечивается определенным соотношением между насыщенными и ненасыщенными жирными кислотами в гидрофобных хвостах полярных фосфолипидов. Жирные кислоты с ненасыщенными связями характеризуются большей гибкостью (в отличие от насыщенных ЖК) и способностью создавать изгибы, что предотвращает плотную упаковку, затрудняет «замораживание» мембран и таким образом влияет на их текучесть ().
Упаковка углеводородов в бислое зависит от температуры. При низких температурах бислой находится в виде геля и упакован плотно, при высоких же температурах (температура тела) бислой фактически «расплавляется» и становится текучим, позволяя липидным молекулам двигаться вокруг своей оси, вращаться, меняться местами. Это, в свою очередь, способствует перемещению уже других компонентов в мембране, в частности белков.
Мембранные гликолипиды. Следующим важным компонентом мембран являются гликолипиды — липиды, содержащие углеводы. Гликолипиды животных клеток, подобно сфингомиелину, являются производными спирта сфингозина, связанного с ацильным радикалом. Отличие между этими липидами заключается в том, что в гликолипидах к сфингозиновому остатку присоединены один или несколько остатков сахара, а в сфингомиелине — фосфорилхолин.
Гликолипиды могут быть простые и сложные. Простейший гликолипид — цереброзид, содержащий только один остаток сахара (глюкозу или галактозу). В более сложных гликолипидах число сахарных остатков может достигать семи (ганглиозиды)
Гликолипиды в мембранах могут выполнять защитную, полупроводниковую, рецепторсвязывающую роль. Среди молекул, способных связываться с гликолипидами, встречаются также такие клеточные яды, как холера, токсин тетануса и др.
Холестерин в мембранах. Другой представитель липидов в мембранах — это холестерин. Количество его в мембранах варьирует в зависимости от типа клеток. В плазматических мембранах в среднем на каждую молекулу фосфолипида приходится примерно 1 молекула холестерина. У других (например, бактерий) — холестерина нет вообще. У холестерина так же, как у фосфолипидов, имеются участки полярные и неполярные.
Внутри мембран холестерин внедряется между фосфолипидами и ориентируется в том же направлении, что и сами молекулы фосфолипидов. Таким образом, полярная головка холестерина оказывается в той же плоскости, что и полярные головки фосфолипидов (рис. 2).
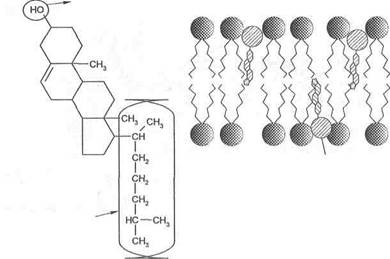
В мембранах холестерин выполняет следующие функции:
■ фиксируют первые несколько ближайших углеводородных групп, входящих в состав фосфолипидных жирных кислот. Это делает липидный бислой более устойчивым к деформациям и ограничивает прохождение через них небольших водорастворимых молекул. В случае отсутствия холестерина (как, например, у бактерий) клетка нуждается в оболочке;
■ предотвращает кристаллизацию углеводородов и фазовые сдвиги в мембране.
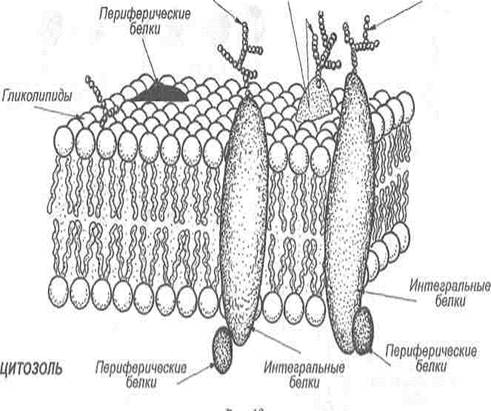
Мембранные белки. В то время как мембранные липиды ответственны за создание барьера проницаемости, мембранные белки опосредуют отдельные функции мембран, т. е. транспорт веществ, передачу информации, энергии и т. д. Соотношение между липидами и белками у разных мембран может быть разным, например, миелин, изолятор нервных клеток, содержит только 18% белков и 76% липидов, а митохондриальная внутренняя мембрана, наоборот — содержит 76% белков и только 24% липидов. В зависимости от характера локализации в мембранах выделяют белки интегральные (трансмембранные), периферические и «заякоренные».
Интегральные белки пронизывают бислой мембраны насквозь и благодаря своим бифильным свойствам фиксируются в нем. Белки, пронизывающие мембрану только один раз, называют однократно пронизывающими белками, а несколько раз — многократно пронизывающими.
Периферические белки локализуются на поверхности мембран и скрепляются только за счет электростатических взаимодействий и водородных связей. Довольно часто периферические белки присоединяются к некоторым участкам интегральных белков (рис. 3).
|
|
Олигосахариды Гликопротеины Олигосахариды
Рис. 3. Белковый состав мембран
«Заякоренные» белки фиксируются в мембранах с помощью коротких хвостовых липофильных доменов, образованных либо за счет гидрофобных аминокислотных остатков (цитохром b5), либо за счет ковалентно связанных ацильных радикалов (фермент щелочная фосфатаза).
Участки белков, которые обращены во внеклеточную среду, могут подвергаться гликозилированию.
Транспортные белки. Мембранным белкам принадлежит решающая роль в транспорте веществ через мембраны, и для выполнения этой роли наилучшим образом подходят интегральные белки, которые охватывают пространство как внутриклеточное, так и межклеточное.
Транспорт веществ через мембраны белки осуществляют различными способами; они могут выступать в качестве белковых насосов, каналов, транспортеров.
АТР - зависимые насосы, представляют собой АТРазы, которые способствуют движению через мембраны ионов или небольших молекул против их концентрационного градиента (или электрохимического потенциала) за счет энергии расщепления АТР. Такой вид транспорта известен как активный транспорт. С активным транспортом сопряжены определенные химические реакции, так, например, благодаря таким насосам в животных клетках обеспечивается поддержание низких концентраций Са2+ внутри клетки и высокое содержание ионов Nа+ в межклеточном пространстве, низкое значение рН в желудочном соке у человека и животных (моногастричных), внутри лизосом клеток, вакуолей растительных клеток.
Белковые каналы обеспечивают быстрое (до 108 молекул в секунду) перемещение одновременно молекул воды и других молекул и ионов по направлению снижения их концентрационного градиента (или электрохимического потенциала). Такие перемещения молекул обычно являются энергетически выгодными. Так, плазматические мембраны всех животных клеток содержат К+ - специфичные белковые каналы, которые открываются и закрываются в определенное время. Другие белковые каналы в это время закрыты и открываются только в ответ на воздействие специальных сигналов. Особенно большую роль играют такие каналы в нервных клетках.
Белки-транспортеры способствуют транспорту различных ионов и молекул через мембрану; однако, в отличие от канальных белков, белки-транспортеры связывают одну (или несколько) молекул субстрата одновременно, что приводит к изменению конформации белка и в результате к транспорту этих связанных молекул через мембрану. Такие транспортеры могут переносить в клетку около 102-104 молекул в секунду, что гораздо медленнее, чем движение по белковым каналам.
Обнаружены 3 типа белка-транспортера.
Юнипортеры осуществляют транспорт через мембрану животных клеток молекул одного типа в сторону уменьшения их концентрационного градиента, например, глюкозу, аминокислоты.
Антипортеры и симпортеры обеспечивают согласованный ко-транспорт одних молекул или ионов через мембрану против их концентрационного градиента с движением других молекул или ионов в процессе их перемещения в сторону уменьшения их концентрационного градиента.
АКТИВНЫЙ ТРАНСПОРТ ЧЕРЕЗ МЕМБРАНУ
Активный транспорт — это транспорт веществ через мембраны за счет потребления энергии расщепления АТР. Активным транспортом осуществляется транспорт некоторых ионов и небольших молекул против их концентрационного градиента.
Белки, участвующие в активном транспорте через мембраны (белковые насосы), условно подразделяют на 4 класса: суперсемейство белков АВС, белки класса Р., F., и V. Белки класса Р., F. и V транспортируют только ионы, а АВС — небольшие молекулы и ионы.
Белки (насосы) Р. - класса состоят из 2 субъединиц - α и β; α - субъединица содержит АТР - связывающий участок и является каталитической, а β - субъединица - регуляторной. Большинство белков этого класса являются тетрамерами, составленными из 2 α, и 2 β - субъединиц. В процессе транспорта, по крайней мере, одна из α - субъединиц сначала подвергается фосфорилированию (поэтому и обозначается как «Р»), и именно через нее происходит транспорт ионов.
К белкам Р - класса относятся:
■ Nа+/К+- АТРаза — фермент, локализованный в плазматической мембране и регулирующий внутриклеточное содержание ионов Nа+ и К+ в клетках животных;
■ Са2+- АТРазы — насосы, перекачивающие ионы Са2+ из цитозоля в межклеточное пространство против их концентрационного градиента для поддержания низкого уровня кальция (10-2 М) в цитоплазме клеток животных, дрожжей и растений. Помимо плазматических Са2+-АТРаз клетки мышц содержат еще другую Са2+-АТРазу (мышечный Са2+-й насос), которая осуществляет перекачивание ионов кальция из цитозоля в саркоплазматический ретикулум (СР) — внутриклеточное хранилище кальция;
■ мембранные белки эпителиальных клеток желудка у млекопитающих, способствующие поступлению соляной кислоты в желудок;
■ Н+- насосы, транспортирующие протоны водорода из клетки взамен поступления ионов К+ внутрь клетки;
■ Н+- насосы, регулирующие мембранный электрический потенциал в клетках растений, грибов, бактерий. Эти насосы не содержат фосфопротеиновой части.
Ионные насосы класса F и V структурно похожи друг на друга, но гораздо сложнее, чем белки класса Р. Насосы F и V состоят из 3 трансмембранных белков и 5 различных полипептидов, которые ориентированы в цитозольную часть белка и формируют внутрицитозольный домен. Некоторые субъединицы трансмембранных белков, ориентированные во внешнюю часть биомембран, структурно аналогичны внутрицитозольным доменным полипептидам.
Насосы класса V в основном участвуют в поддержании низкого значения рН в вакуолях растений и лизосомах и других кислотных везикулах животных клеток за счет расходования энергии расщепления АТР и перекачивая протоны водорода через мембрану из цитозоля в межклеточное пространство против протонного электрохимического градиента. Насосы класса F найдены в плазматических мембранах бактерий, мембранах хлоропластов и митохондрий. В отличие от насосов класса V их функция в основном направлена на синтез АТР из АDР и неорганического фосфата за счет движения протонов водорода из цитозольного межмембранного пространства в сторону уменьшения электрохимического градиента.
Последний класс АTР - зависимых транспортных белков — это суперсемейство АВС (АТР-binding cassette). Этот класс включает до 100 различных транспортных белков, и обнаружены они в клетках всех организмов. Каждый АВС - белок специфичен по отношению к одному какому-то субстрату, или группе субстратов, похожих друг на друга, включая ионы, углеводы, пептиды, полисахариды и даже белки.
Все АВС - транспортные белки объединяет наличие у них 4 главных доменов — двух трансмембранных доменов (Т), образующих так называемые ворота для «прохождения» молекул через мембрану, и двух внутрицитозольных домена (А), участвующих в связывании АТР. Таких АТР - связывающих участков у АВС - белков могут быть один или два, и их часто называют АТРазами, хотя и не всегда они проявляют АТР - гидролизующие свойства. В отдельных случаях такие трансмембранные белки могут проявить АТР - синтезирующие свойства, что играет решающую роль при синтезе АТР в митохондриальных мембранах.