Под ретракцией понимается самопроизвольное отделение сыворотки от кровяного сгустка при отстаивании. Исследование производится в уленгутовских пробирках. Кровь набирают в сухую и обезжиренную спиртом и эфиром пробирку и отстаивают при комнатной температуре (15—18°) в течение суток. Отметив начало и конец ретракции, через сутки вся отделившаяся сыворотка отсасывается и затем определяется отношение сыворотки к общему объему взятой крови.
При исследовании необходимо придерживаться единой методики, так как результат во многом зависит от диаметра пробирки, положения ее и свойства самой стенки. Степень ретракции зависит также от рода животного. У лошади частичная ретракция кровяного сгустка наступает через 1—3 часа, а полное отделение сгустка—через 12—18 часов. У крупного рогатого скота ретракция протекает очень слабо и нередко отсутствует совсем. У других животных ретракция почти не изучена. Индекс ретракции у здоровых лошадей в среднем равняется 0,5 (0,3—0,7).
Ослабление ретракции связывают с уменьшением тромбоцитов и изменением концентрации солей. Уменьшение ретракции с индексом 0,3,0,2 и 0,1 отмечается при многих лихорадочных процессах. Полное отсутствие ретракции отмечается при экссудативном плеврите, контагиозной пневмонии, кровепятнистой болезни лошадей. Особенна большое значение имеет изменение ретракции при стахиботриотоксикозе. Первым изменением со стороны крови бывает постепенно усиливающееся падение ретракции. Полная потеря способности кровяного сгустка отделять сыворотку называется ирретрактильностью. Другие изменения—тромбопения, лейкопения и изменение лейкоцитарной формулы присоединяются несколько позднее.
Кишечная форма стахиботриотоксикоза, протекающая в форме легкого катара, может незаметно перейти в септическую, нередко заканчивающуюся смертью животного. Резкое падение ретракции и особенно ирретрактильность кровяного сгустка при этой форме заболевания указывает на переход заболевания из одной формы в другую, в септическое страдание. Своевременное изъятие корма, пораженного грибками, может восстановить здоровье животного и избавить хозяйство от значительных потерь.
Реакция оседания эритроцитов (РОЭ). Несмотря на простоту методики реакция оседания эротроцитов представляет сложное явление.
Казалось бы, что оседание эритроцитов легче всего объяснить разницей в удельном весе эритроцитов и жидкой части крови. Средний удельный вес эритроцитов 1,100, а плазмы 1,030. Но это объяснение совершенно недостаточно. Эритроциты лошади оседают то быстро, то медленно, хотя различие в удельном весе остается прежним. Кровь крупного рогатого скота оседает медленно, хотя разница в удельном весе есть и в крови рогатого скота. Если удельный вес и имеет некоторое значение в оседании эритроцитов, то имеются и другие факторы, которые оказывают влияние на оседание.
Все эритроциты имеют одинаковый электрический заряд, вследствие чего происходит отталкивание их друг от друга. Если заряд эритроцитов уменьшить или снять, например добавкой ОН-ионов в форме аммиака, то электростатическая сила взаимного отталкивания исчезнет. Соответственно с этим увеличивается и способность эритроцитов к оседанию.
К силам, способствующим оседанию эритроцитов, принадлежит также адсорбция на поверхности эритроцитов: альбуминов и глобулинов. Эритроциты в этом случае становятся тяжелее и поэтому быстрее оседают. В значительной степени оседание эритроцитов зависит от соотношения альбуминов и глобулинов.
Грубодисперсные (высокомолекулярные) глобулины ускоряют реакцию оседания эритроцитов. В плазме лошади имеется большое количество глобулинов, а в плазме рогатого скота больше альбуминов. У лошади РОЭ протекает быстро, в то время как у крупного рогатого скота в тех же условиях почти не происходит.
На скорость оседания эритроцитов оказывает влияние беременность. При беременности увеличивается количество глобулинов и вследствие этого РОЭ ускоряется. При инфекционных заболеваниях на скорость оседания эритроцитов оказывают влияние глобулиновые иммунные тела.
Известное значение имеет количество содержащегося в плазме фибриногена, который, оседая на эритроцитах, образует вязкий гель. Эритроциты, соприкасаясь поверхностями, склеиваются в кучки, агглютинируются и падают на дно. С увеличением фибриногена скорость РОЭ соответственно увеличивается.
Пирогов и Мухин основным фактором, определяющим быстроту оседания эритроцитов, считают количество красных кровяных телец. При уменьшении их оседание ускоряется, а при увеличении, напротив, замедляется.
Кроме того, на РОЭ оказывает влияние щелочной резерв крови, липоидно-холестериновый коэффициент и содержание различных солей. Уменьшение щелочного резерва замедляет ход РОЭ, повышение, напротив, ускоряет его. Соли кальция и бария действуют ускоряющим образом, а соли калия и натрия задерживают оседание. Холестерин, при увеличении его в крови, ускоряет РОЭ, а лецитин, напротив, замедляет.
Несмотря на выраженное влияние одного какого-нибудь фактора, конечный результат оседания зависит от влияния всех факторов, вместе взятых. Этим и можно объяснить то, что РОЭ дает одни и те же изменения при совершенно различных процессах. При учете результатов необходимо учесть, кроме того, и внешние факторы, такие, как температура, концентрация раствора, чистота посуды и положение аппарата при определении РОЭ.
Из многочисленных методов, предложенных для определения РОЭ (Пан-ченко, Балаховский, Вестергрен и Неводов и др.), наибольшее распространение в ветеринарной практике получил метод Неводова и Вестергрена.
Метод Неводова. Для постановки РОЭ необходимо иметь эритро-сидиометр Неводова, представляющий собой градуированную пробирку объемом 10 мл, шириной 9 мм и высотой 17 см, с резиновой пробкой. В нее предварительно насыпают 0,03 порошка щавелевокислого натрия, а затем из яремной вены берется кровь до метки 0.
После взятия крови пробирка закрывается резиновой пробкой и 10—15 раз поворачивается для перемешивания крови и оксалата натрия. Кровь смешивается осторожно, чтобы избежать появление пузырей.
Пробирка ставится вертикально в штатив и через каждые 15 минут в течение часа отмечается уровень оседания эритроцитов.
Средняя скорость оседания эритроцитов определяется за час, делением суммы четырех измерений (15, 30, 45, 60 минут) на число измерений. Средняя скорость у здоровой лошади составляет 43 (38—48).
Метод Вестергрена. РОЭ ставится в аппарате Вестергрена, выпускаемом Госмедснабом с небольшими изменениями против оригинала.
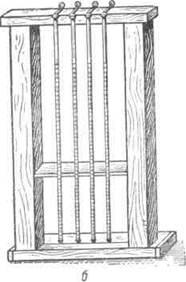
Аппарат состоит из деревянной рамы и четырех градуированных пипеток, одним концом вдавленных в каучук подставки, а другим прочно зафиксированным специальными клеммами на верхней раме. Длина каждой пипетки 30 см и ширина 2,5 мм. На боковой стороне каждой пипетки нанесены деления от 0 до 200 (иногда наоборот).
В небольшой цилиндр предварительно наливают 1 мл 3,8%-ного водного раствора лимоннокислого натрия. В раствор добавляют 4 мл крови, взятой из яремной вены. Кровь в цитрате тщательно перемешивают (избегать вспенивания) встряхиванием или стеклянной палочкой. Перемешанную с раствором кровь набирают в пипетку Вестергрена до метки 0 и, обтерев пипетку, устанавливают ее в подставку, прочно фиксируя между клеммой и основанием подставки.
Аппарат заряжается при горизонтальном положении пипетки, с целью избежать преждевременного оседания эритроцитов. Заряженный аппарат быстро переводится в вертикальное положение и сейчас же приступают к наблюдению
|
Рис. Аппараты для определения РОЭ. Панченкова (а) И Вестергрена (б). |

За оседанием, засекая время. Учет РОЭ ведется через каждые 5 минут в течение первого часа и через 10 минут в течение второго часа. Спустя 2 часа, когда оседание почти закончено, аппарат переносят в покойное место и оставляют на 24 часа в течение которых оседание заканчивается полностью. Столбик крови постепенно разделяется на две части: верхний—плазма и нижний—эритроциты.
Недостатком метода Вестергрена является то, что он требует постоянного наблюдения в течение 2 часов. Практически удобнее регистрировать через 15, 30, 45, 60 минут, через 2 часа и последний через 24 часа. Метод Панченкова. Этод метод в ветеринарной практике используется при исследовании мелких животных, т. к. требует меньшего количества крови. У птиц, например, кровь для этого метода можно получить уколом в мякоть гребня или сережек.
Аппарат Панченкова имеет такое же устройство, как и аппарат Вестергрена и отличается от него тем, что пипетки имеют меньшую емкость и градуированы только на сто делений. На капилляре имеется две метки: метка К (кровь) на высоте нулевой точки и метка Р (реактив)—на точке соответствующей 50 мм.
Вначале в капилляр набирается 0,25 мм заготовленного заранее 5% раствора лимоннокислого натрия и затем выдувается в маленькую фарфоровую чашечку или на часовое стекло. После этого до метки 100 капилляра набирается кровь. Кровь затем выдувается в цитрат и осторожно перемешивается пипеткой. Цитратная кровь набирается в пипетку до метки К и устанавливается в штатив.
Если крови достаточное количество, можно раствора брать до метки 50 мм и крови 2 раза по полному капилляру. Соотношение, как и в первом случае, получится то же самое—4 : 1.
Учет реакции производится через 1 час и через 24 часа. РОЭ ставится или сразу после взятия крови или не позднее чем через 2 часа. По данным Мухина, через три часа после взятия получаются значительные индивидуальные колебания РОЭ как в сторону ускорения, так и замедления.
У животных РОЭ протекает неодинаково. У крупного рогатого скота и собак РОЭ идет медленно, причем основная масса эритроцитов оседает в промежуток между 2 и 24 часами. У цельнокопытных оседание эритроцитов, напротив заканчивается в основном в течение первого часа и только 5—8% приходится на остальные 23 часа. Основная масса эритроцитов оседает в промежуток между 15 и 45 минутами.
Наглядное представление о разнице в протекании РОЭ у животных дает следующая таблица:
|
115 мин. |
330 мин. |
445 мин. |
660 мин. |
Фамилия автора |
|
|
Крупный рогатый скот Овцы Козы Олени Лошади Свиньи Собаки Кошки Кролики Куры |
0,1 0,2 0,0 0,7 38,0 3,0 0,2 0,1 0,0 2,0 |
0,25 0,4 0,02 3,25 49,0 8,0 0,9 0,7 0,3 10,0 |
0,4 0,6 0,6 4,9 60,0 0,0 1,7 1,8 0,9 7,0 |
0,58 0,8 1,0 6,2 64,0 0,0 2,5 3,0 1,5 5,0 |
Д. Соколов Л. Лебедев B. Чагин A. Неводов C. Хрусталев и B. Сидоров C. Смирнов A. Васильев B. Зайцев |
У молодых животных РОЭ несколько более ускорено, чем у взрослых животных.
При патологических процессах РОЭ может быть ускорена и замедлена. Чаще приходится наблюдать ускорение РОЭ и реже замедление. Отражая изменение физико-химических свойств крови, РОЭ имеет большое практическое значение.
Ускорение РОЭ отмечается при многих лихорадочных и инфекционных заболеваниях. Особенно значительное оседание эритроцитов отмечается при инфекционной анемии лошадей и кровепятнистой болезни. В ряде случаев при этих заболеваниях оседание полностью заканчивается в течение первых 15—30 минут. Резкое ускорение РОЭ при массовом обследовании лошадей дает возможность выделять подозрительных по заболеванию.
С улучшением процесса РОЭ изменяется в сторону замедления, однако только при полном выздоровлении РОЭ возвращается к нормальным показателям.
Замедление РОЭ отмечается при механических илеусах и при энцефало-миэлите лошадей. При этих заболеваниях РОЭ по своему характеру такая же, как у крупного рогатого скота. Менее значительное замедление можно встретить при заболеваниях, связанных с желтухами и сгущением крови.
Для оценки скорости оседания эритроцитов Неводов рекомендует пользоваться следующим критерием. Отклонение на 13—24% (17—33 деления) расценивается, как незначительное замедление; отклонение на 25—50% (32—20) указывает на замедление средней силы, а на 55% и больше (ниже 20)—резкое замедление.
54—66 делений указывает на ускорение средней степени, а 67 и выше— резкое ускорение.
РОЭ, кроме диагностических целей, пытаются использовать для определения утомляемости лошадей, ее пригодности к определенной работе. Критерием является замедление РОЭ. Сравнение показателей производится до работы и после работы. У малонатренированных лошадей после работы отмечается значительное замедление РОЭ. Если животное постепенно втягивается в работу, то и показатели постепенно меняются и приближаются к средним показателям здоровой лошади.
Возможность определения количества эритроцитов в 1 мм3 по показателям РОЭ, а также установления волюметрического индекса и индекса оседания повышают клиническое значение этого метода.
В пробирке Неводова количество эритроцитов указывается на той же шкале, на которой показаны цифры оседания эритроцитов. В пипетках Вестергрена цифра на уровне столба эритроцитов после 24-часового стояния крови умножается на коэффициент 0,21, в результате чего получают цифру, показывающую количество эритроцитов в 1 мм3. Следует, однако, отметить, что эти методы могут быть использованы только как ориентировочные. Более точные показатели получаются при подсчете в счетных камерах.
Волюметрический индекс представляет собой отношение столба эритроцитов к общей массе крови. Его определяют делением высоты столба эритроцитов после 24-часового стояния на 100. У здоровых лошадей волюметрический индекс равняется 1:2, 1:3. При анемиях отношения делаются значительно шире.
Индекс оседания определяется делением показателя столба плазмы после 15-минутного оседания на показатель высоты конечного столба после 24-часового оседания. У здоровых животных индекс оседания не превышает 0,5, при анемиях он увеличивается до 0,8—0,9.
Осмотическая резистентность эритроцитов. Плазма крови содержит такую концентрацию минеральных солей, что силы осмотического давления плазмы и внутреннее осмотическое давление в эритроцитах взаимно уравновешены. Растворы, имеющие осмотическое давление, равное внутреннему осмотическому давлению эритроцитов, называются изотоническими. В таких растворах эритроциты сохраняют свою форму и величину.
В гипертонических растворах эритроциты отдают свою воду и сморщиваются, принимая форму тутовой ягоды. В гипотонических растворах происходит обратное явление. Эритроциты набухают вследствие поступления воды в клетку и увеличиваются в объеме. Гемоглобин набухших эритроцитов выщелачивается, и клетка в конечном итоге распадается.
В изотонических растворах подобных изменений не происходит, так как здесь нет условий для интенсивных осмотических явлений.
Изотонической средой для эритроцитов животных является 0,85—0,9%-ный раствор поваренной соли, а также 3%-ный раствор NaSO4*10H2O.
Гипо-и гипертонические растворы оказывают различное влияние на эритроциты в зависимости от концентрации. Растворы, близкие по концентрации к изотоническим, сохраняют основную массу эритроцитов и действуют отрицательно только на отдельные малоустойчивые клетки, вызывая частичный гемолиз. Чем меньше концентрация раствора, тем большее количество эритроцитов подвергается разрушению. В растворах низкой концентрации наступает полный гемолиз, и жидкость окрашивается в вишнево-красный цвет.
Начальная стадия гемолиза наименее стойких эритроцитов характеризуется слабым розоватым окрашиванием жидкости с наличием большого осадка сохранившихся эритроцитов. Концентрация гипотонического раствора, обусловливающего начальную стадию гемолиза, обозначается как показатель минимальной резистентности эритроцитов. Концентрация, обусловливающая появление полного гемолиза с вишнево-красным окрашиванием прозрачной жидкости и отсутствием осадка, определяет максимальную резистентность. Амплитуде между минимальной и максимальной резистентностью эритроцитов принято называть шириной резистентности.
Наглядное представление о резистентности эритроцитов в растворах различной концентрации дает следующая таблица (по В. П. Петропавловскому).
Принято считать, что молодые эритроциты малоустойчивы осмотически и сильно устойчивы к гемолитическим ядам. Старые, напротив, устойчивы осмотически и малоустойчивы к гемолитическим ядам (Шустров). Следовательно, определение максимальной и минимальной устойчивости эритроцитов позволяет клиницисту делать выводы о процессах регенерации крови. Чем больше в крови будет находиться молодых эритроцитов, т. е. чем энергичнее функционируют кроветворные органы, тем ближе к изотонии сдвинется граница минимальной резистентности; наоборот, недостаточная работа кроветворных органов вызовет постарение крови и отклонение резистентности в сторону убывающей гипотонии.
(По В. П. Петропавловскому)
|
Концентрация Раствора (в %) |
Окраска раствора После центрифугирования |
Осадок Эритроцитов |
Заключение |
Границы резистентности |
|
0,9 |
Бесцветный |
Большой |
Гемолиза нет |
|
|
0,8 |
» |
» |
» » |
|
|
0,7 |
» |
» |
» » |
|
|
0,6 |
Слабо окрашен |
Есть |
Частичный гемолиз |
Минимальная резистентность |
|
0,5 |
Окрашен |
» |
Все более увеличив, гемолиз |
|
|
0,4 |
» |
Незначительный |
То же |
|
|
0,3 |
Интенсивно окрашен |
Отсутствует |
Полный гемолиз |
Максимальная резистентность |
|
0,2 |
То же |
» |
То же |
Резистентность эритроцитов у здоровых животных
|
Вид животного |
Минимальное |
Максимальное |
Фамилия автора |
|
Крупный рогатый скот.... |
0,74—0,64 |
0,46—0,42 |
Д. Соколов |
|
Овцы........................................................ |
0,80—0,76 |
0,50—0,46 |
Л. Лебедев |
|
Козы........................................................ |
0,77—0,63 |
0,59—0,47 |
В. Чагин |
|
Яки........................................... |
0,60—0,56 |
0,48—0,42 |
П. Карасев |
|
Лошади.................................................. |
0,62—0,52 |
0,44—0,38 |
С. Хрусталев и В. Сидоров |
|
Свиньи................................................. |
0,86—0,78 |
0,48—0,42 |
С. Смирнов |
|
Собаки................................................. |
0,58—0,54 |
0,41—0,33 |
Ф. Михайлов |
|
Кошки..................................................... |
0,64—0,60 |
0,50—0,42 |
Баранов |
|
Кролики............................................. |
0,46—0,42 |
0,34—0,32 |
А. Васильев |
Если норма, например, равна 0,6, то отклонение в сторону 0,7—0,8 будет указывать на понижение резистентности, а в сторону 0,4— 0,3, напротив,—на повышение резистентности.
В основе всех рекомендуемых методов положен принцип: менее стойкие эритроциты разрушаются в растворах, близких к изотоническим, а наиболее стойкие сохраняются в растворах малой концентрации, в которых большая часть эритроцитов разрушается.
Метод Лимбека—Рибьера. Для определения резистентности эритроцитов используются растворы поваренной соли в концентрации от 0,3 до 0,9% с интервалом в 0,02. Растворы в количестве 1 мл набираются в центрифужные пробирки. После этого в каждую пробирку добавляется пипеткой от гемометра Сали кровь в количестве 20 мм3. Перемешав жидкость и выждав 10—15 минут, пробирку устанавливают в центрифугу и через 5 минут просматривают результат. В пробирках, где произошел частичный гемолиз, жидкость окрашена в слаборозовый цвет и на дне пробирки имеется значительный осадок. В пробирке с полным гемолизом жидкость окрашивается в вишнево-красный цвет и становится совершенно прозрачной. Легкое желтоватое окрашивание расценивается как показатель начала гемолиза, а слабое покраснение за начало выраженного гемолиза.
Метод Гамбургера. Для определения резистентности эритроцитов используется сернокислый натрий в концентрации от 0,3 до 0,9% с интервалом в 0,02. Гемолиз наступает несколько позднее, чем в растворах с поваренной солью, которая травмирует оболочку эритроцитов. Для определения резистентности по этому методу необходимо иметь пробирки с притертыми пробками. Пробирки с раствором выдерживаются при температуре 14°, а затем центрыфугируются. Оценка результатов такая же, как и по методу с поваренной солью.
Метод Яновского. Учет разрушенных и сохранившихся эритроцитов производится в счетной камере. Кровь набирают в смесители Для Подсчета эритроцитов и разводят растворами поваренной соли различной концентрации. Подсчет производится через 10 минут после того, как будут заполнены смесители.
Вместо обычного изотонического раствора Зиммель предложил пользоваться следующим раствором: 8,2 хлористого натрия, 0,2 хлористого калия, 0,2 хлористого магния, 0,2 хлористого кальция, 0,1 фосфорно-кислого натрия, 0,05 углекислого натрия на 1 литр воды. Этот раствор принимается за основной, из которого готовят дальнейшие разведения—0,7, 0,6, 0,5, 0,4, 0,3. Эти разведения и используются для определения резистентности эритроцитов.
Зиммель предложил также суправитальное окрашивание сохранившихся эритроцитов с целью определения количества эритроцитов с гранулофиламен-тозной субстанцией. Это позволяет решить вопрос о том, какие эритроциты являются наиболее стойкими—старые или молодые.
Для суправитального окрашивания 1 %-ный спиртовый раствор бриллианткрезилбляу наносится на покровное стекло. Вначале определяется количество эритроцитов в основном (изотоническом) растворе, а затем последовательно в растворах убывающей концентрации—0,7, 0,6, 0,5, 0,4, 0,3, с одновременным учетом молодых эритроцитов.
Техника заполнения смесителей и камеры такая же как при обычном подсчете эритроцитов. Подсчет эритроцитов—обычный. Отличным является только окрашивание покровного стекла бриллианткрезилбляу перед наложением его на счетную камеру и учет молодых эритроцитов.

