Ознакомление с микроскопированием мазков.
Изучить морфологию микроорганизмов: а) приготовление препаратов, б) окраска препаратов.
Изучение морфологии микроорганизмов.
Бактерии. Морфология бактерий зависит от условий выращивания на питательных средах, температуры и других факторов. Наиболее типична морфология бактерий в молодых культурах. По форме бактерии делятся на шаровидные, палочковидные и извитые.
К морфологическим свойствам относятся не только форма, но и размер клеток, наличие спор и капсул, подвижность и характер окраски бактерий по Граму. Для изучения морфологии бактерий в лабораториях готовят препараты.
Приготовление препаратов. Препараты (мазки) готовят из бактериальных культур. Бактериальная чистая культура - это потомство одной микробной клетки, т. е. расплодка одного вида микроба (без примеси других), выросшая на питательной среде.
При приготовлении препаратов из культуры бактерий, выросших на питательных средах, необходимо соблюдать правила стерильности. Пробирку с культурой берут в левую руку, помещают между большим и указательным пальцами и держат в наклонном положении. Бактериологическую петлю (металлическая или платиновая проволока на стержне) берут правой рукой и прокаливают на пламени горелки или спиртовки. Мизинцем правой руки вынимают ватно-марлевую пробку из пробирки и держат ее, не касаясь окружающих предметов около пламени горелки. Края пробирки слегка обжигают на пламени, вносят стерильную петлю в пробирку, охлаждают ее, не прикасаясь к внутренним стенкам. Затем набирают небольшое количество культуры, вынимают петлю из пробирки, которую закрывают пробкой, пронося предварительно через пламя горелки. Пробирку ставят в штатив и приступают к приготовлению мазка.
Для приготовления препарата из бульонной культуры на чистое, обезжиренное предметное стекло стерильной петлей наносят каплю взвеси и равномерно распределяют ее по поверхности стекла в форме мазка размером 1,5-2,5 см.
Если препарат готовят из культуры, выращенной на плотной питательной среде, то вначале на стекло наносят каплю стерильной воды, а затем в эту каплю вносят небольшое количество культуры и тщательно растирают.
После нанесения культуры на стекло бактериологическую петлю прокаливают над пламенем горелки, а препарат высушивают на воздухе, затем фиксируют на пламени, проводя 3-4 раза тыльной стороной стекла (мазком вверх) через пламя горелки. При фиксации микроорганизмы погибают и прикрепляются к стеклу. Мертвые клетки окрашиваются лучше, чем живые.
Окраска препарата. Фиксированный препарат окрашивают, так как при рассматривании под микроскопом неокрашенных мазков микробные клетки не видны. Для окрашивания бактерий в лабораториях применяют рабочие (водные) растворы анилиновых красителей (метиленовой сини, фуксина основного, сафранина, малахитовой зелени и др.). Краски разливают в специальные склянки с пипетками.
Бактерии окрашивают Простым и сложным методами.
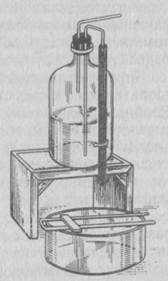
Простой метод окраски проводят следующим образом: на фиксированный мазок наносят 2-3 капли водного раствора одного красителя (например, фуксина или метиленового синего) и окрашивают в течение 2-3 мин. Затем краску смывают, препарат тщательно промывают водой и просушивают между листками фильтровальной бумаги и рассматривают под микроскопом. Для приготовления и окраски препаратов используют установку для промывания препаратов (рис. 2). На подставку помещают бутыль, промывают препараты на мостике, расположенном на сливной чашке.
При Сложном методе окраску проводят двумя или более красителями. Сложные методы окраски бактерий основаны на физико-химических свойствах микробной клетки. Их применяют для детального изучения строения бактерий и их различия. Наиболее распространенным сложным методом окраски микробов является метод Грама, предложенный в 1884г. Для окраски по Граму на фиксированный мазок кладут полоску фильтровальной бумаги, наносят 2-3 капли генцианвиолета на 1-2 мин,
![]() Рис.2
Рис.2
Снимают пинцетом бумажку, сливают остаток краски и наливают 2-3 капли раствора Люголя на 1-2 мин. Затем раствор сливают и на мазок наносят несколько капель этилового спирта-ректификата на 30-40 с. После этого мазок промывают водой и окрашивают фуксином (2-3 капли раствора на 1-2 мин). Препарат тщательно промывают водой, просушивают фильтровальной бумагой и рассматривают под микроскопом с иммерсионным объективом.
Одни бактерии по методу Грама окрашиваются в фиолетовый цвет (грамположительные), другие - в розовый цвет (грамотрицательные). Различие окраски бактерий обусловлено неодинаковым химическим составом клеточной стенки. У грамположительных бактерий больше муреина (до 95 %), чем у грамотрицательных (всего 5-10 %).
1) клеточных стенках грамположительных бактерий муреин связан в основном с полисахаридами, среди которых большое место занимают тейхоевые кислоты. Такой химический состав клеточной стенки прочно удерживает фиолетовый краситель и не обесцвечивается спиртом.
В клеточных стенках грамотрицательных бактерий муреин связан и основном с липидами. Тейхоеные кислоты отсутствуют. Микробная клетка таких бактерий не обладает способностью прочно удерживать фиолетовую окраску. При обработке спиртом обесцвечивается, и дополнительная окраска фуксином придает клетке розовый цвет.
Окраска спор. Для окраски спор в лабораториях часто пользуются методом Меллера, Шсффера-Фултона и др.
Метод Меллера заключается в следующем. На фиксированный над пламенем мазок наносят несколько капель 5 %-ного раствора хромовой кислоты на 3-5 мин. Затем промывают водой, высушивают. На мазок кладут полоску фильтровальной бумаги и наносят 3-4 капли карболового фуксина Пиля, окрашивают с подогреванием (до появления паров) в течение 3-5 мин. Краску смывают и мазок обесцвечивают 5 %-ным раствором серной кислоты в течение 30-40 с. Мазок вновь промывают водой и окрашивают раствором метиленового синего в течение 1-2 мим. После промывания водой и высушивания фильтровальной бумагой мазок рассматривают под микроскопом. Споры окрашиваются в красный цвет, вегетативные части клетки - в синий.
Метод Шеффера-Фултона заключается в следующем. Фиксированный мазок окрашивают 5 %-ным раствором малахитовой зелени с подогревом до появления паров в течение 1-2 мин. Затем препарат промывают водой и дополнительно окрашивают 0,5 %-ным водным раствором сафранина в течение 1 мин. Остаток краски смывают водой и мазок просушивают фильтровальной бумагой. При микроскопии в поле зрения микроскопа споры выглядят зелеными, вегетативные формы - красными.
Окраска капсул. В лабораториях часто проводят исследования для выявления капсул. Капсула плохо воспринимает окраску и при простых методах окраски не выявляется. Капсула хорошо окрашивается по методу Романовского-Гимза, Муромцева и др. Метод Романовского-Гимза заключается в следующем. Фиксированный мазок окрашивают краской фабричного изготовления, в которую входят азур и эозин. Краску разводят водой 1:10 и препарат окрашивают в течение 20-30 мин. Затем мазок промывают, просушивают фильтровальной бумагой. Капсула окрашивается в розовый цвет, тело микробной клетки - в синий.
По Методу Муромцева фиксированный препарат окрашивают готовой краской Муромцева 20-30 с, промывают водой и высушивают. Капсулы окрашиваются в бледно-розовый цвет, микробная клетка - в темно-синий.
Плесневые грибы. Для изучения морфологии плесневых грибов готовят препараты методом раздавленной капли, а для определения подвижности микробов - методами раздавленной капли и висячей капли. Затем препараты рассматривают под микроскопом с объективом 8 и 40 при слегка опущенном конденсоре.
Метод Раздавленной капли основан на следующем. На середину чистого, обезжиренного предметного стекла наносят бактериологической петлей каплю культуры микроорганизмов, выращенную в жидкой питательной среде, осторожно накрывают покровным стеклом. Капля тонким слоем заполняет пространство между покровным и предметным стеклом.
Для приготовления препарата из культуры микробов, выращенных на плотной питательной среде, вначале на предметное стекло наносят каплю стерильной воды, а затем в нее вносят небольшое количество изучаемых микроорганизмов и накрывают покровным стеклом.
Метод Висячей капли заключается в следующем. Культуру микроорганизмов наносят бактериологической петлей на покровное стекло, а к нему прикладывают предметное стекло с углублением (лункой). Края лунки предварительно смазывают вазелином, чтобы прикрепить покровное стекло. Для рассматривания под микроскопом препарат помещают на предметный столик покровным стеклом вверх, т. е. к объективу. Капля свободно висит в луночке и долго не высыхает, что позволяет длительное время наблюдать за подвижностью микробных клеток.
При изучении морфологии плесневых грибов на предметное стекло необходимо нанести каплю воды и из культуры двумя препаровальными иглами (иглы, закрепленные в деревянные палочки) внести небольшой кусочек мицелия гриба. Его осторожно расщепляют на стекле, не разрушая гифов, спорангиеносцев, конидиеносцев, накрывают покровным стеклом и рассматривают под микроскопом.
Мукор (головчатая плесень) - Одноклеточный плесневый гриб. Спорангиеносцы расположены одиночно, реже кустиками. Мицелий пушистый, в верхней части образует множество черных головок. Споры серые, округлой или овальной формы, при микроскопировании просвечиваются.
Пенициллиум - Плесневый гриб, конидиеносцы имеют перегородки, разветвленные в виде кисточек, на концах ветвей расположены стеригмы, а на них округлые, гладкие споры в виде цепочек (конидии). Мицелий низкий, врастает в питательную среду. Колонии плесени окрашены в зеленый цвет.
Аспергиллюс - Плесневый гриб, конидиеносец одноклеточный без перегородок. Стеригмы располагаются на булавовидном утолщении конидиеносца. От стеригм отходят по радиусам споры (конидии) округлой формы черного цвета.
Молочная плесень — Мицелий белого цвета с перегородками. Конечные нити мицелия распадаются, образуя споры круглой, овальной и прямоугольной форм (оидии).
Гроздевидная плесень - Конидиеносец многоклеточный. От него отходят круглые оливково-зеленые овальной формы конидии, располагающиеся в гроздевидные скопления. Колонии плесени окрашены в черный цвет.
Шоколадная плесень - Конидии шоколадно-коричневого цвета, образуют длинные в виде бус цепочки.

