Общая характеристика представителей семейства Reoviridae
Семейство Reoviridae (от англ. respiratore enteric orphan) — большая группа вирусов, поражающая позвоночных, насекомых и растения.
Вирионы реовирусов представляют собой икосаэдрические частицы диаметром 60—80 нм и состоят из сердцевины и двойного капсида — наружного и внутреннего. В состав сердцевины входят белок и РНК. В вирионах реовирусов содержится 78—86 % белка и 14—22 % РНК. Мол. м. вирионов около 120 МД, плавучая плотность bCsCI 1,36-1,39 г/см3.
Геном реовирусов состоит из 10—12 уникальных фрагментов 2-спиральной линейной РНК с мол. м. 0,2—3,0 МД, кодирует один белок. Общая мол. м. вирионной РНК 12—20 МД. Природа связи фрагментов неясна, вероятно, они соединены друг с другом с помощью белковых молекул. В вирионах реовирусов обнаружено 6—10 полипептидов с мол. м. 15—155 кД. Некоторые белки гликозилированы. Липиды в составе этих вирусов не выявлены. С сердцевиной вирионов ассоциирована транскриптазная активность этого семейства. Реовирусы размножаются в цитоплазме клетки с образованием характерных цитоплазматических включений, содержащих РНК и вирусные белки. Формирование вирионов тесно связано с микротрубочками. Генетическая рекомбинация между различными реовирусами в пределах рода происходит очень эффективно. В основе механизма рекомбинации лежит перераспределение (реассортация) фрагментов РНК.
Наибольшее значение в инфекционной патологии животных имеют представители рода Reovirus и Orbivirus, молекулярная биология которых подробно описана в недавних работах. Они вызывают заболевание у телят, поросят, ягнят, цыплят и индюшат. Параротавирусы изучены недостаточно, так как они не размножаются в культуре клеток. Только ротавирус свиней группы С удалось серийно пассировать в первичной культуре клеток почек поросят и перевиваемой культуре клеток МА-104. Ротавирусы других групп называют атипическими или параротавирусами. Ротавирусы группы А обнаружены у многих видов млекопитающих и птиц; группы В — у человека, КРС, свиней, овец, крыс; группы С — у человека, КРС, свиней; групп D, F и G — у птиц; группы Е — у свиней. По наличию типоспецифических АГ-детерминант в белках VP7 (гликопротеин) и VP4 (протеазочувствительный белок) ротавирусы группы А подразделяют на 14 G серотипов и 12 Р серотипов. Ниже приводятся современные представления о классификации, структурной организации, составу и молекулярным механизмам репликации этих вирусов.
Семейство Reoviridae состоит из 9 родов: Orthoreovirus; Orbivorus; Coltivirus; Rotavirus; Aquareovirus; Cypovirus; Phytoreovirus; Fijivirus и Oryzavirus. Род Orthoreovirus (от греч. orthos — правильный) включает реовирусы типов 1, 2 и 3 (прототипный вирус). Естественные хозяева этого рода вирусов — люди, обезьяны, КРС, собаки, птицы и летучие мыши. Диаметр вирионов составляет 76 нм, сердцевины — 52 нм. От сердцевины отходят 12 полых выступов (шипов), которые достигают наружной поверхности вириона. Через эти выступы выходят синтезированные транскрипты. Мол. м. вирионов 130 МД, коэффициент седиментации — 730S. Они устойчивы к воздействию эфира и стабильны при рН 3—9. В вирионах и сердцевинах содержится соответственно 14 и 44 % РНК, доля гуанина (Г) и цитозина (Ц) составляет 44 %. Кроме 2-спиральной РНК, в вирионах обнаружено около 3000 1-спиральных олиго-нуклеотидов длиной от 2 до 20 нуклеотидов. Геном состоит из 10 фрагментов 2-спиральной РНК с мол. м. 0,5-2,7 МД, общая мол. м. РНК 14-15 МД. В вирионах обнаружено 9 полипептидов с мол. м. 38—155 кД, три из которых входят в состав наружного капсида. Минорный полипептид наружного капсида — типоспецифический АГ.
1. Род Orbivirus (от лат. orbis — кольцо) включает вирусы блутанга (24 серотипа), африканской чумы лошадей, эпизоотической геморрагической болезни оленей, энцефалоза лошадей, Кемерово, Чангинола, Коррипарта, Юбенанджи, Пальям, Валлал, Варрего (2 серотипа). Типичный представитель рода — вирус блутанга серотипа 1 (синего языка, катаральной лихорадки овец). Вирионы орбивирусов имеют диаметр 65—80 нм. Наружный капсид рыхлый, без четко различимых структур и легко удаляется при центрифугировании в CsCl. Внутренний капсид состоит из 32 капсомеров кольцевидной формы. На поверхности сердцевин нет выступов. Мол. м. вирионов 80 МД, коэффициент седиментации 550S. Вирусы инактивируются при рН 3,0; при воздействии растворителей липидов инфекционность их снижается в 10 раз.
В вирионах содержится 20 % РНК, доля Г+Ц составляет 42—44 %. Геном состоит из 10 фрагментов 2-спиральной РНК с мол. м. 0,5—2,8 МД; общая мол. м. РНК 15 МД. В вирионах обнаружено 7 полипептидов с мол. м. 35—150 кД, два из которых (Р2 и Р5) входят в состав наружного капсида. Полипептиды наружного капсида содержат типо-специфические АГ детерминанты и индуцируют синтез ВНА. Естественными хозяевами орбивирусов являются люди, обезьяны, лошади, КРС, олени, овцы, кролики, мышата-сосуны, насекомые и клещи. Вирусы передаются от одного хозяина к другому кровососущими членистоногими.
3. Род Coltivirus (от англ. Colorado tick fever) включает вирус колорадской клещевой лихорадки (прототипный вирус) и вирусы, выявленные в Индонезии и Китае у КРС, свиней, человека, москитов и клешей. Вирионы колтивирусов имеют диаметр 80 нм. Выступов на поверхности сердцевин не обнаружено. Представители рода теряют инфекционность при рН 3,0. Геном состоит из 12 фрагментов 2-спиральной РНК с мол. м. 0,24-2,5 МД; общая мол. м. РНК 18 МД.
4. Род Rotavirus (от лат. rota — колесо) играет важную роль среди инфекционных агентов, вызывающих острые гастроэнтериты у молодых животных различных видов. Типичный представитель рода — ротавирус человека (SA 11 — прототипный вирус). В состав рода включены также ротавирусы обезьян, КРС, свиней, лошадей, овец, коз, оленей, собак, кроликов, кошек, морских свинок, мышей и птиц.
Все ротавирусы по наличию группоспецифического ГА, выявляемого различными методами (ИФ, ИФА, ИЭМ), подразделяют на семь групп: А, В, С, D, E, F, G. Ротавирусы каждой группы независимо от их происхождения имеют общий групповой АГ, обусловленный белком внутреннего капсида VP6. Ротавирусы групп А, В и С обнаружены у человека и животных, а групп D, Е и F — только у животных. Большинство ротавирусов человека и животных относят к группе А (типичные ротавирусы). Ротавирусы других групп называют атипичными, или параротавирусами. Вирионы ротавирусов представляют собой сферические частицы диаметром 65-75 нм, состоящие из сердцевины, внутреннего и наружного капсида. Сердцевина имеет гексагональную форму и состоит из трех белков (VP1, VP2, VP3) и РНК, Диаметр ее 40—45 нм, внутренний капсид имеет икосаэдрическую форму и построен из 260 морфологических единиц, каждая из которых представлена тремя молекулами белка VP6. Диаметр внутреннего капсида составляет 15—20 нм. Наружный капсид состоит из коротких капсомеров, прикрепленных непосредственно к концам капсомеров внутреннего капсида. Он построен из 780 молекул белка VP7. Диаметр наружного капсида составляет 5—10 нм. На поверхности наружного капсида обнаружено 60 шипов длиной 4,5—6,0 нм и шириной около 3,5 нм, представляющих собой димеры белка VP4.
Секвенированы гены неструктурного белка NSP4 (1) 15 штаммов ротавирусов (РВ) свиней, лошадей, коров, кроликов и собак и сравнены с секвенированными ранее РВ человека и других животных. Штаммы РВ кроликов и лошадей относятся к генотипу D по NSP4. Мышиные РВ образуют новый генотип D, который более дивер-гентен по отношению к генотипам А В и С, чем эти генотипы по отношению друг к другу. В пределах генотипов по белку NSP4 штаммы РВ кроликов, лошадей и коров (генотип А) и свиней (генотип В) группируются в соответствии с видом хозяина. Это указало на консервативный характер эволюции РВ в пределах видов хозяев. Сравнены последовательности гена белка NSP4 штамма РВ кроликов дикого типа и двух штаммов, адаптированных к культурам тканей кроликов и вызывающих болезнь у новорожденных крольчат. Не обнаружены аминокислотные замены в консервативной части NSP4 (остатки 130—141). Это позволило предположить, что болезнь является результатом заражения РВ кроликов, сопровождающегося продукцией энтеротоксиHa NSP4.
5. Род Aquareovirus (от лат. aqua — вода) включает вирусы американского леща (прототипный вирус), сомов, кеты. Возможный представитель рода — реовирусы линя, голавля, кижуча, моллюсков. Диаметр вирионов 75 нм, сердцевины 50 нм, плавучая плотность вирионов в CsCl 1,36 г/см3. Геном состоит из 11 фрагментов 2-спираль-ной РНК с мол. м. 7 МД. В составе вирионов обнаружено 7 белков с мол. м. 34—136 кД.
6. Род Cypovirus (от англ. cytoplasmic polihedrosis) включает вирусы цитоплазматического полиэдроза тутового шелкопряда Bombyx mori (прототипный вирус) и многих насекомых отрядов двукрылых (Diptera), чешуекрылых (Lepidoptera), перепончатокрылых (Hymenoptera). Диаметр вирионов 50—65 нм, мол. м. 50 МД, коэффициент седиментации 370—440 S. Вирионы устойчивы к действию эфира и стабильны при рН 3,0. Геном состоит из 10 фрагментов 2-спиральной РНКс мол. м. 0,3—2,7 МД. В вирионах обнаружено 3—5 полипептидов с мол. м. 30—151 кД. Вирусы размножаются в насекомых с образованием крупных белковых включений (полиэдров), содержащих вирионы.
Роды 7. Phytoreovirus, 8. Fijivirus и 9. Oryzavirus включают реовирусы растений.
Посредством ИФА у ротавирусов выявлены подгруппоспецифические АГ, которые связаны с белком внутреннего капсида VP6 и белком сердцевины VP2. По наличию подгруппоспецифических АГ-детерминант ротавирусы подразделяют на четыре подгруппы. Большинство ротавирусов животных входит в состав первой подгруппы. Типоспецифические АГ ротавирусов ассоциированы с белками наружного капсида VP4 и VP7.
По наличию типоспецифических детерминант в белке VP7 ротавирусы подразделяют на 11 серотипов: G-серотипы (табл. 1.1). У животных и птиц обнаружено семь серотипов ротавирусов (3, 4, 5, 6, 7, 10 и 11-й): у свиней — четыре (3, 4, 5, 11-й), у КРС — два (6, 10-й), у лошадей — 2 (3, 5-й) и по одному у животных остальных видов.
Таблица 1.1 Классификация ротавирусов группы А на основании типоспецифических детерминант наружного капсидного белка VP7
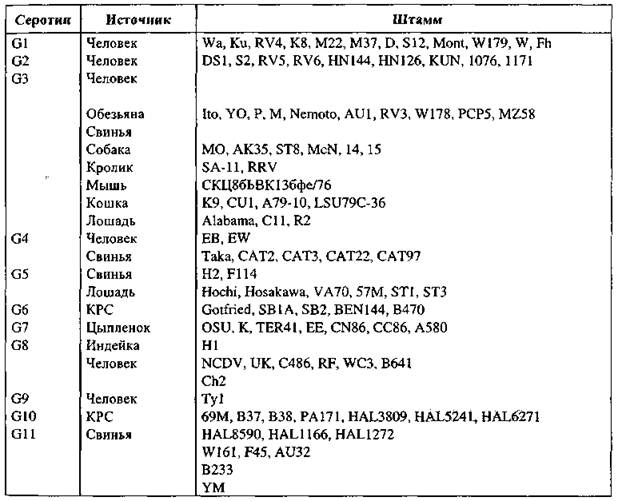
Третий серотип ротавирусов выявлен у семи видов животных. Наибольшее число серотипов (6) идентифицировано у человека. По наличию типоспецифических АГ-детерминант на белке VP4 (протеазочувствительном) ротавирусы подразделяют на Р-серотипы. Для типирования ротавирусов, наряду с серологическими реакциями, используют также гибридизационный анализ.
Отличительная черта структуры ротавирусов — наличие 132 каналов, пронизывающих наружный и внутренний капсиды и соединяющих наружную поверхность вириона с сердцевиной. Эти каналы обеспечивают проникновение метаболитов, необходимых для транскрипции РНК, и выход вновь синтезированных молекул РНК из сердцевины. В препаратах ротавирусов встречают 2-капсидные и 1-капсидные частицы, а также частицы, лишенные сердцевины («пустые» ви-рионы). Диаметр 2-капсидных частиц 70-75 нм, 1-капсидных 60-70 нм. Под электронным микроскопом вирионы ротавирусов напоминают колесо с широкой ступицей (сердцевина), короткими спицами (внутренний капсид) и четко очерченным ободом (наружный капсид). Поэтому они получили такое название — ротавирусы.
Структурные белки. В вирионах ротавирусов обнаружено шесть белков, три из которых (VP1—VP3) входят в состав сердцевины, причем белок VP2 составляет 15 % маесы всех белков (табл. 1.2).
Таблица 1.2 Характеристика структурных белков ротавирусов
|
Обозначение |
Молекулярная |
Содержание в вирионе, |
Локализация |
|
Белка |
Масса, кД |
% от массы всех белков |
|
|
VP1 |
125 |
2 |
Сердцевина |
|
VP2 |
102 |
15 |
Сердцевина |
|
VP3 |
98 |
0,5 |
Сердцевина |
|
VP4 |
87 |
1,5 |
Наружный капсид |
|
VP6 |
45 |
51 |
Внутренний капсид |
|
VP7 |
37 |
30 |
Наружный капсид |
Белок VP6 — основной компонент внутреннего капсида, на его долю приходится примерно половина массы вирионных белков. Наружный капсид состоит из двух белков (VP4 и VP7), один из которых — VP7 гликозилирован. Белки наружного капсида — очень важные компоненты вириона. Они ответственны за прикрепление вирионов к поверхности клетки, обусловливают ГА и индуцируют синтез В НА. Под воздействием трипсина белок VP4 расщепляется на два белка (VP5 и VP8), в результате чего повышается инфекционная активность вируса.
В вирионах ротавирусов обнаружена РНК-зависимая РНК-полимераза (транс-криптаза), которая связана с сердцевиной вирионов. Транскриптаза проявляет активность после удаления белков наружного капсида. Вероятно, белки сердцевины VP1 и VP3 обладают транскриптазной активностью. Для проявления активности вирион-ассоциированной транскриптазы in vitro необходимо присутствие в системе всех четырех рибонуклеозидтрифосфатов и ионов Mg2+. Продуктом полимеразной реакции являются 1-спиральные молекулы РНК, которые чувствительны к действию РНК-азы и полностью гибридизируются с вирионной РНК. Кроме транскриптазы в составе вирионов обнаружены поли(А)-полимераза, гуанилилтрансфераза, метилт-рансфераза и нуклеотидфосфогидролаза.
Структура генома. Геном ротавирусов состоит из 11 уникальных фрагментов 2-спиральной РНК с мол. м. от 0,2 до 2,2 МД. Суммарная мол. м. всех фрагментов РНК ротавирусов 11 — 14 МД. Фрагменты РНК присутствуют в вирионах в эквимолярных количествах. Природа связи фрагментов РНК не ясна. Фрагменты РНК могут быть разделены при электрофорезе в полиакриламидном геле или агарозе. В соответствии с электрофоретической подвижностью фрагменты РНК подразделяют на четыре класса: 1-й класс включает фрагменты 1—4-й; 2-й класс — фрагменты 5 и 6; 3-й класс — фрагменты 7—9; и 4-й класс — фрагменты 10—11. Электрофоретическая подвижность фрагментов РНК внутри классов ротавирусов не одинакова не только у животных разных видов, но и одного вида. Подвижность 10- и 11-го фрагментов РНК у различных ротавирусов сильно варьирует. В связи с этим, различают «длинные» и «короткие» электрофоретипы РНК ротавирусов, соответствующие большей и меньшей электрофоретической подвижности этих фрагментов.
Степень родства между геномами разных ротавирусов определяют гибридизацией синтезированных in vitro 1-спиральных фрагментов РНК с соответствующими дву-спиральными фрагментами геномной РНК гомологичного и гетерологичного вирусов. Частичная гомология обнаружена между геномами ротавирусов телят и обезьян.
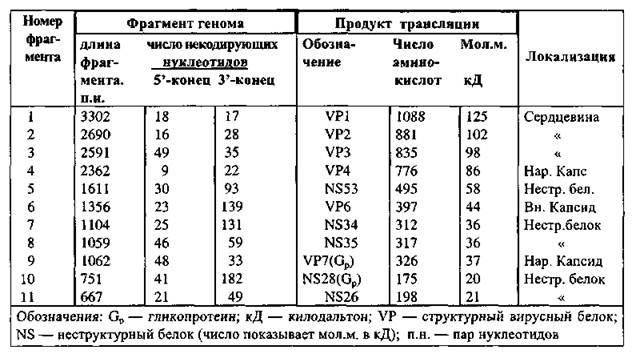
В последнее время выяснены кодирующие функции каждого фрагмента вирионной РНК ротавируса обезьян SA-11 и определена его полная первичная структура генома (табл. 1.3).
Таблица 1.3. Характеристика фрагментов геномной РНК и кодируемых ими белков ротавирусов обезьян SA-11
Для установления кодирующей функции генома ротавирусов фрагменты РНК разделяют электрофорезом в полиакриламидном геле, денатурируют при высокой температуре, транслируют in vitro и идентифицируют продукты трансляции. Трансляции подвергают также РНК, синтезированные in vitro с помощью вирион-ассоциированной РНК-полимеразы.
Геном ротавируса обезьян SA-11 состоит из 18 555 пар нуклеотидов. Длина фрагментов генома варьирует от 667 (11-й фрагмент) до 3302 (1-й фрагмент) пар нуклеотидов. На концевых участках всех фрагментов содержатся нетранслируемые консервативные последовательности, которые необходимы для инициации транскрипции, репликации и трансляции вирусных генов. Нетранслируемые участки составляют лишь 6,3 % длины генома.
Свойства и функции белков ротавирусов. Белок сердцевин ы и внутреннего капсида. VP1 кодируется 1-м фрагментом генома у всех изученных ротавирусов и входит в состав сердцевины. В сыворотке крови естественно и экспериментально инфицированных животных AT к белку VP1 не выявляются. Сравнение аминокислотной последовательности белка VP1 у ротавирусов обезьян, КРС и человека выявило высокую степень гомологии (89—96 %). Незначительное количество этого белка, содержащееся в вирионе (около 2 % массы всех белков), свидетельствует о том, что он скорее является частью энзиматического комплекса, чем выполняет структурную роль. Вероятно, белок VP1 — компонент вирион-ассоциированной транскриптазы.
Белок VP2 кодируется 2-м фрагментом генома и в качестве основного белка (15 % массы всех белков) входит в состав сердцевины. Он связывается с 1- и 2-спиральной РНК ротавирусов и содержит два обогащенных лейцином участка. У ротавирусов обезьян, КРС и человека установлена высокая степень гомологии (91—92 %) этого белка. По-видимому, белок VP2 связывает фрагменты генома друг с другом и играет важную роль в сборке вирионов. Белок VP3 кодируется 3-м фрагментом генома и служит минорным компонентом сердцевины (0,5 % массы всех белков). Идентификация этого белка затруднялась из-за его низкого содержания в вирионах и зараженных клетках. Белок VP3, вероятно, — компонент РНК-полимеразы и совместно с белком VP1 принимает участие в репликации вирусной РНК.
Белок VP6 кодируется 6-м фрагментом генома и является единственным белком внутреннего капсида. Он составляет 51 % Массы всех вирионных белков. В изолированном состоянии и в составе вирусных частиц представляет собой тример. Обладает кислыми свойствами и полимеризуется с образованием трубчатых структур при низком значении рН. Участвует втранскриптазной активности 1-капсидных частиц. Удаление его из этих частиц сопровождается потерей транскриптазной активности. Добавление белка приводит к восстановлению активности, однако непосредственно он не вовлекается в транскрипцию. Вероятно, белок VP6 обусловливает информационные изменения сердцевины, необходимые для функционирования полимеразного комплекса. Белок VP6 содержит группоспецифические и подгруппоспецифические детерминанты. С помощью монАТ установлено наличие пяти не перекрывающихся детерминант. Роль его в индукции протективного иммунитета не ясна.
Белок наружного капсида. VP4 кодируется 4-м фрагментом генома и представляет негликозилированный минорный компонент наружного капсида (1,5 % массы всех белков). Он ответствен за ГА-активность и синтез ВНА. В присутствии трипсина белок VP4 расщепляется на два белка с мол. м. 60 кД (VP5) и 28 кД (VP8). В результате расщепления белка повышается инфекционная активность вируса. Процесс протео-литической активности ротавирусов при нарезании белка наружного капсида аналогичен процессу расщепления поверхностных белков у пара - и ортомиксовирусов. Белок VP4 функционирует на ранних этапах взаимодействия вируса с клеткой. Расщепление его активизирует проникновение вируса через плазматическую мембрану, но не влияет на его взаимосвязь с клеткой. Этот белок индуцирует у животных протектив-ный иммунитет. Белок VP4 ротавирусов животных состоит из 776 аминокислот и расщепляется трипсином в двух сайтах (аргинин 241 и аргинин 247), причем расщепление во 2-м сайте происходит чаще с помощью монАТ. В белке VP8 обнаружены серо-типоспецифические, а в белке VP5 — эпитопы, перекрестно реагирующие в РН.
Белок VP7 кодируется девятым фрагментом у ротавируса обезьян SA-11 (8-м фрагментом у ротавируса КРС) и является гликозилированным основным компонентом наружного капсида (30 % массы всех белков). Он состоит из 326 аминокислот и содержит два тандемных гидрофобных участка на N-конце и один сайт гликолизиро-вания в положении 69—71. У некоторых штаммов ротавирусов КРС и человека этот белок имеет два сайта гликолизирования. Первые 50 аминокислот этого белка представляют собой сигнальную последовательность, которая отщепляется и не входит В Состав вириона. Белок VP7 — основной протективный АГ, вызывающий образование ВНА, ответственен за прикрепление вируса к клеткам. AT к этому белку блокируют адсорбцию вируса на клетках. Вероятно, участок белка VP7, обусловливающий адсорбцию вируса, находится на карбоксильном конце белка (аминокислоты 275—295). В VP7 выявлены серотипспецифические и перекрестно реагирующие эпитопы нейтрализации. Конформация белка VP7 определяется дисульфидными связями и необходима для сохранения нейтрализующих эпитопов. Гипериммунная сыворотка к очищенному денатурированному белку VP7 не обладает нейтрализующей активностью. Нейтрализующие монАТ не реагируют с денетурированным белком VP7. Гликозилирование белка VP7 не является необходимым условием для адсорбции и проявления инфекционной активности вируса, однако углеводные остатки играют важную роль в стабилизации вирусной частицы и экспонировании антигенных детерминант в этом белке.
Неструктурный белок NS53 кодируется пятым фрагментом генома и обнаруживается в инфицированных ротавирусами клетках на ранних стадиях инфекции. Синтез белка, вероятно, контролируется, так как в инфицированных клетках он образуется в меньших количествах, чем в бесклеточной белоксинтезирующей системе. Однако о механизме регуляции синтеза этого белка в клетках ничего не известно. Белок N S53 обладает основными свойствами и содержит два участка связывания с Zn в положении 54—66 и 314—327. Белки, связывающие Zn, обычно взаимодействуют с нуклеиновой кислотой. Возможно, белок NS53 участвует в репликации вирусной РНК. Белок NS35 кодируется фрагментами 7—9 генома в зависимости от штамма ротавируса (UK — 7-м, SA-11 — 8-м, RRV — 9-м фрагментом) и обладает основными свойствами. Иммуноцитохимическими методами выявлена связь этого белка с виропластами в инфицированных клетках. Полагают, что он принимает участие в репликации вирусной РНК или в упаковке 1-спиральных РНК в субвирусные частицы.
У ротавируса обезьян SA-11 белок NS34 кодируется фрагментом 7 и обладает кислыми свойствами, обнаруживается в комплексах, изолированных из инфицированных клеток и содержащих репликазную активность, возможно — компонент вирусной репликазы.
Белок NS28 кодируется 10-м фрагментом генома и является гликопротеином. На N-конце этого белка имеется неотщепляемая сигнальная последовательность, в которой локализованы два сайта гликозилирования. Белок NS28 N-концом встроен в мембраны эндоплазматического ретикулюма, а его С-конец находится в цитоплазме. Цитоплазматический фрагмент белка принимает участие в морфогенезе вирусных частиц и служит рецептором для 1-капсидных частиц, обеспечивая их почкование в просвет эндоплазматического ретикулюма. Гликозилирование его необходимо для удаления временной (транзитной) оболочки из почкующихся частиц. Добавление туникамицина (ингибитора гликолизирования) приводит к накоплению оболочечных частиц в клетках.
Белок NS26 кодируется 11-м фрагментом генома, обогащен серином и треонином и является фосфопротеином. Он связан с виропластами в инфицированных клетках и, вероятно, участвует в репликации вирусной РНК.
Антигенная вариабельность и родство. В настоящее время различают не менее четырех серотипов ротавируса человека. Известно о существовании не менее трех серо-типов ротавирусов группы Асвиней. Кроме того, известны ротавирусы свиней, относящиеся к серогруппам В, С и Е. Серогрупповая серотиповая вариантность имеет место у ротавирусов КРС и других животных. В перекрестной РН тесное АГ-родство выявлено между ротавирусами обезьян и свиней, а также между ними и ротавирусами КРС. Гомология первичной структуры VP7 различных серотипов достигала 71—85 %. Различная степень АГ-родства по VP4 обнаружена между ротавирусами, выделенными от свиней, человека, обезьян и собак.
Шт. АН-1, выделенный от человека, характеризовался высокой гомологией с рота-вирусом, выделенным от кошек (FRV-1). От КРС при диарее выделен ротавирус, геномная РНК которого была аналогичной ротавирусу птиц. Ротавирусы человека и свиней имели высокую степень гомологии нуклеотидных последовательностей и могли иметь общего предка. В другие АГ-группы также входят ротавирусы, поражающие различных хозяев. Вирусы, имеющие одного хозяина, могут настолько сильно различаться между собой, что представляют разные группы. Штаммы ротавирусов, относящиеся к одному серотипу, но выделенные от животных разных видов, часто имеют более тесную связь, чем штаммы различных серотипов, выделенные от животных одного вида.
В группу В входят ротавирусы человека, КРС, в группу С — человека и свиней, группа Е и F — свиней, группу D — птиц. Геномный 4-й сегмент ротавируса обезьян происходит от ротавируса КРС. Ротавирусы обезьян, свиней и кроликов в экспериментальных условиях легко инфицировали телят. Ротавирус человека вызывал летальную инфекцию у новорожденных поросят при оральном заражении. Существуют ротавирусы, обладающие двойной субгрупповой специфичностью. Такая уникальная способность обнаружена, например, у ротавируса лошадей (шт. F1 —14), который взаимодействовал с АГ 1 и 2-й субгрупп. Известен штамм ротавируса свиней с двойной се-ротипоспецифичностью (G3 и G5). Природа АГ-полиморфизма у ротавирусов пока не выяснена. Приведенные данные свидетельствуют о возможности пересечения ротавирусами видовых барьеров и их миграции между различными классами и видами млекопитающих в естественных условиях.
В последнее время у КРС, свиней и человека были обнаружены атипичные ротавирусы, не имеющие группоспецифического АГ, несмотря на типичную для ротавирусов морфологию. Они были названы параротавирусами. Атипичные штаммы были обнаружены в 5 % случаев при ротавирусных инфекциях у свиней и в 1 % — при ротавирусных диареях у КРС. При изучении с помощью ЭФ в ПААГ выявлены различия в профиле геномов этих штаммов и типичных ротавирусов. В 1988 г. в Японии был выделен новый вирус Shenzam. Он вызывал спорадические случаи врожденных аномалий и гидроэнцефалит у телят. У КРС при внутривенном введении его обнаруживается только лейкопения. В эритроцитарной фракции крови вирус определяется в течение нескольких недель. Помимо эритроцитов, вирус выявляли также во фракции тромбоцитов и никогда не обнаруживали в лейкоцитарной фракции. При интра-церебральном заражении у телят развивалась летальная инфекция с тяжелыми невра-логическими поражениями. Этот вирус выделяли из мозжечка, лимфоузлов.
Вирус Shenzam относится к роду Orbivirus, подгруппе Poliam. Двунитчатая геномная РНК шт. К-47 вируса Shenzam состоит из 10 фрагментов с мол. м. от 2,35-106 до 9,32-106. Тотальный размер его генома равен 11,75 МД. Среди 10 структурных вирионных белков его масса варьирует от 23 до 130 кД; три (95, 86 и 23 кД) являются мажорными. Вирус Shenzam хорошо репродуцируется в клетках ВНК-21 (титрЮ7 ТЦД50/мл). На его основе разработана инактивированная вакцина, предотвращающая лейкопению и виремию.
Полагают, что этот вирус, возможно, является этиологическим агентом конгенитальных деформаций у КРС, относится к серогруппе Polyam рода Orbivirus, сем. Reoviridae и представляет собой новый серотип.
Параротавирусы свиней, в отличие от ротавирусов, вызывают образование синци-тиев из энтероцитов в тонком кишечнике. Отмечена АГ вариабельность среди пара-ротавирусов свиней. Несмотря на выраженную АГ специфичность, ряд ротавирусов индуцирует ВНА к гетерологичным ротавирусам.
Вирулентность. Для идентификации генов, ответственных за вирулентность, животных заражают одновременно двумя штаммами ротавирусов, обладающими различной вирулентностью. В результате смешанной инфекции происходят обмен фрагментами генома (пересортировка генов) и образование реассортантов. При исследовании реассортантов, содержащих различные комбинации фрагментов, установлено, что 4-й фрагмент генома ротавирусов ответствен за вирулентность. Продукт этого гена (белок наружного капсида VP4) обусловливает проникновение вируса в клетку. МонАТ к этому белку блокируют проникновение вируса через клеточную мембрану. Вирулентность ротавирусов, вероятно, также связана с 9-м фрагментом генома, кодирующим белок наружного капсида VP7. Этот белок определяет взаимосвязь между вирусом и клеткой. МонАТ к белку VP7 ингибируют адсорбцию вируса на клеточной поверхности.
Референс-штаммы ротавирусов животных — штаммы: бычий NCDV, свиной OSU, обезьяний СА-11, человеческий NA. В перекрестной РН выявлено АГ различие штаммов ротавируса КРС (BRV007, BRV-14, HN-7, BRV6555) от референтного бычьего штамма ротавируса NCDV. Изолят RO 1845 ротавируса человека, выделенный в Израиле, оказался первым изолятом, обладающим ГА активностью.
Молекулярно-биологические подходы к созданию вакцин. Поверхностные белки ротавирусов VP4 и VP7 — иммуногены, индуцирующие синтез ВНА. Поэтому для конструирования субъединичных вакцин можно использовать пустые капсиды, изолированные белки наружного капсида и синтетические пептиды, соответствующие АГ детерминантам белков VP4 и VP7. В связи с множественностью серотипов ротавирусов представляет интерес получение вакцинных штаммов-реассортантов, которые содержат фрагменты генома, кодирующие белки VP4 и VP7 из различных серотипов. При этом реассортанты ротавирусов индуцируют у животных иммунный ответ к обоим родительским штаммам ротавируса. Перспективен также метод получения генно-инженерных вакцин, основанный на выделении фрагментов 4- и 9-го генома, получении ДНК-копий и экспрессии их в прокариотических или эукариотиче-ских клетках при использовании соответствующих генно-инженерных конструкций. Синтезированные белки VP4 и VP7 вызывают образование ВНА у экспериментальных животных и предохраняют их от заражения ротавирусом. Предложен метод потенцирования иммунного ответа против ротавирусного антигена у животных с помощью совместного введения антигена и адъюванта, представленного вирусным эн-теротоксином или его производными (в частности, белком NSP4 ротавирусов группы А генотипов А В, С или D).
Для вакцинации птиц, свиней и человека против заражения ротавирусами предложено использовать плазмидные ДНК, кодирующие белки VP4, VP6 или VP7 РВ под контролем транскрипционных или трансляционных регуляторных последовательностей (например, предраннего энхансера-промотора цитомегаловируса или интрона А). Описаны методы иммунизации этими плазмидными ДНК, инкапсулированными в микрочастицы или покрывающими частицы золота.
Особенности репродукции. Ротавирусы, обработанные трипсином, непосредственно проникают через клеточную мембрану, причем проникновение сопровождается «раздеванием» вириона (удаление внешнего капсида). В цитоплазме клеток через 5 мин после заражения обнаруживают субвирусные частицы, лишенные наружного капсида. Активация ротавирусов трипсином связана с расщеплением белка наружного капсида VP4 на два белка: VP5 и VP8. ВНА блокируют проникновение вируса через плазматическую мембрану. Не обработанные трипсином ротавирусы проникают в клетку в результате рецепторного эндоцитоза, и через 20 мин их обнаруживают в лизосомах. Однако они не подвергаются «раздеванию» и не происходит продуктивной инфекции.
Геном ротавирусов транскрибируется в составе субвирусных частиц в цитоплазме с помощью вирионной РНК-зависимой РНК-полимеразы. При этом транскрипции подвергаются лишь минус-нити 2-спиральных фрагментов РНК. Синтезированные плюс-РНК представляют собой полноразмерные копии всех 11 фрагментов РНК и не подвергаются аутогибридизации. Они не содержат по-ли(А)-последовательности и функционируют как информационные РНК (иРНК), направляя синтез вирусных белков в бесклеточной белоксинтезируюшёй системе.
Синтез иРНКротавирусов в инфицированных клетках подвергается качественному и количественному контролю. Качественный контроль обнаружен только при подавлении синтеза белка в инфицированных клетках. В этих условиях транскрибируются лишь четыре фрагмента РНК. Количественная регуляция выражается в том, что иРНК одних фрагментов синтезируются в гораздо большем количестве, чем иРНК других фрагментов. Синтез иРНК сохраняется на высоком уровне в течение 9—12 ч после заражения. В системе in vitro вирусные сердцевины не обладают транскриптаз-ной активностью, однако добавление в смесь белка VP6 восстанавливает эту активность. Вероятно, активация РНК-транскриптазного комплекса связана с конформа-ционным изменением сердцевины.
В клетках синтезируются шесть структурных и пять неструктурных вирусспеии-фических белков. Структурный белок VP7 и неструктурный белок NS28 гликозили-рованы и синтезируются на рибосомах, связанных с мембранами эндоплазматичес-кого ретикулума. Два структурных белка (VP4 и VP7) подвергаются посттрансляционному процессингу. Вновь синтезированные белки обнаруживают в клетках через 4 ч после заражения.
1-спиральные плюс-РНК, синтезированные на 2-спиральной родительской РНК, служат матрицами для синтеза минус-РНК. Синтез 2-спиральных РНК осуществляется во вновь образующихся субвирусных частицах (репликазные частицы), которые в процессе репликации РНК претерпевают структурные изменения.
Формирование и выделение вирионов. Вирионы ротавирусов формируются по принципу самосборки. В результате процессов самосборки в виропластах образуются сердцевины и 1-капсидные вирусные частицы. Вероятно, белок VP2 связывает фрагменты генома и играет важную роль в сборке сердцевины. Неструктурные вирусные белки, по-видимому, также участвуют в этом процессе.
Созревание ротавирусов происходит почкованием 1-капсидных частиц через мембраны эндоплазматического ретикулума в вакуоли с покрытием их псевдооболочкой. В просвете вакуоли псевдооболочка утрачивается, формируется наружный капсид и появляются зрелые вирионы. Неструктурный белок-гликопротеин NS28, встроенный в мембраны эндоплазматического ретикулюма, играет существенную роль в созревании вирионов. Он, вероятно, обеспечивает связь белка наружного капсида VP7 с 1-капсидными частицами при сборке вирионов. При подавлении гликозилирова-ния туникамицином псевдооболочка с поверхности вирусных частиц не удаляется и 2-капсидные вирионы не обнаруживаются. Формирование наружного капсида существенно зависит от концентрации ионов Са2+. При отсутствии их в культуральной среде почкования не происходит и зрелые вирионы в зараженных клетках не выявляются. Вирионы ротавирусов выходят из клеток после их лизиса. РВ активирует структурные и функциональные повреждения, локализованные в плотных контактах (TJ) в формируемых монослоях культивируемых клеток кишечника человека Сасо-2. Инфекция РВ вызывает прогрессивное повышение параклеточной проницаемости (ЗН) маннитола, как функции времени после заражения, дезорганизацию связанного с TJ белка окклюдина, как функции времени после заражения, тогда как распределение зоны прилипания, связанного с Е-кадхерином, не изменялось. Эти повреждения не были связаны с изменениями сложности клеток и монослоя, но изменялась устойчивость трансэпителиальной мембраны и освобождение лактатдегидрогеназы. При использовании стабилизатора нитей актина ясплакинолида, индуцированные РВ структурные и функцинальные изменения в TJ не зависят от индуцированной РВ активации апикального F-актина. Наружные капсидные белковые выступы VP4 являются главным протеином для прикрепления ротавируса (РВ). Проведенные исследования показали, что большинство РВ животных, как и человека, инфицируют пермиссивные клетки без участия сиаловой кислоты.
Инфекционность ротавирусов. Наличие внешнего капсидного слоя необходимо для проявления инфекционности ротавирусов и транскриптазной активности. В популяции вирионов ротавируса телят «гладкие» (с двойным капсидным слоем) и «шероховатые» (лишенные наружного капсидного слоя) в градиенте CsC имеют плотность 1,36 и 1,38 г/см3 соответственно, причем первые в расчете на вирион обладают в 1000 раз более высокой инфекционностью, чем вторые. Для концентрации ротавирусов используют фреон, который удаляет покрывающие вирус компоненты хозяина и способствует сорбции на фильтрах, что обеспечивает выделяемость его от больных до 90 %. Данный метод позволяет накопить концентрированный вирус для биохимических исследований. Наблюдалось различие в патогенности двух ротавирусов свиней, различающихся ростовыми характеристиками. Так, вариант 4F ротавируса свиней, который репродуцировался более медленно и образовывал мелкие бляшки in vitro, имел более быстро мигрирующий ген и оказался патогенным для свиней, тогда как вариант 4S был не патогенен (9).
Культивирование. Предложен способ получения ротавирусных АГ в клеточных культурах с последующей очисткой и концентрированием их. С целью повышения выхода АГ в среду за 24 ч до заражения клеточной культуры добавляют гидрокортизон в количестве 0,03—0,07 мг/мл. Очистку и концентрирование осуществляют адсорбцией ротавирусного АГ на сорбенте при рН 4,0—5,0 с последующей элюцией при рН 8,2.
Диагностика и идентификация ротавирусных инфекций. Разработан новый метод индикации ротавирусного АГ с использованием Staphylococus aurens Cowan-1. Для выявления генетического различия и сходства между ротавирусами млекопитающих предложен метод РНК-РНК-блот-гибридизации с применением в качестве зондов меченых Р32 полных наборов 11 геномных РНК из нескольких штаммов. В большинстве случаев степень сходства нуклеотидных последовательностей оказалась выше в случае пар штаммов ротавирусов, выделенных от одного и того же хозяина. Однако из этого правила наблюдались и исключения. В частности, выделенный от человека шт. АИ-1 характеризовался высокой гомологией с кошачьим шт. FRV-1. Для идентификации вариантов РВ предложено использовать метод точечной ДНК-РНК-блот-гибридизации без радиоактивной метки. В качестве зондов для гибридизации используют меченные биотином 40-членные синтетические оли-годезоксирибонуклеотиды, комплементарные к участку гена VP7 ротавируса. Чувствительность этого метода оказалась более высокой, чем метода ЭФ в ПААГ и И ФА.
Для оценки эффективности новых препаратов для диагностики ротавирусной инфекции, а также анализа и обработки результатов выбран и апробирован единый математический подход (алгоритм), позволяющий определить выявляемость, специфичность, вероятность установления положительного и отрицательного диагнозов, суммарный показатель совпадения результатов диагностики с референтным методом, коэффициенты х2< Рп2, указывающие на достоверность связи с референтным методом и силу этой связи. Для ускорения статистического обсчета результатов разработана компьютерная программа «Диатест». Использование алгоритма и программы позволяет оценить сравнительную эффективность препаратов для диагностики не только ротавирусных инфекций, но и других заболеваний.

