Лимфоидные образования, ассоциируемые со слизистыми оболочками трубкообразных органов
Барьер для инородных белков, которые проникают в каналы органов пищеварения, дыхания, мочеотделения и воссоздания из внешней среды, образованный диффузной или узелковой лимфоидной тканью ассоциируемой со слизистыми оболочками.
Слизистая оболочка трубкообразных органов непосредственно взаимодействует с внешней средой. Потому она, неслучайно, содержит лимфоидные образования, такие как и миндалины, кишечные бляшки, одиночные и групповые лимфоидные узелки. Как правило, многочисленные лимфоидные узелки содержатся в слизистой оболочке и подслизистой основе трубкообразных органов на определенном расстоянии один от другого.
Лимфоидные образования ассоциируемые со слизистыми оболочками трубкообразных органов состоят из диффузной лимфоидной ткани и лимфоидных узелков [267].
Образование лимфоидных узелков в слизистых оболочках трубкообразных органов проходит в четыре этапа [261, 266, 267]. На первом этапе в толще слизистой оболочки образуются скопления диффузной лимфоидной ткани, которая имеет идентичное строение без заметного роста плотности размещения лимфоцитов. На втором этапе, среди диффузной лимфоидной ткани образуются круглой или овальной формы плотные скопления лимфоцитов и происходит процесс образования первичных лимфоидных узелков. На третьем этапе, рядом с увеличением размеров лимфоидных узелков и образованием маргинальной зоны, появляются центры размножения (более светло на гистотопограммах окрашенных гематоксилином и эозином), в которых много клеток находится на стадии митотического деления. Это вторичные (герминативные) лимфоидные узелки, которые образуются в ответ на действие антигенов. Постепенное исчезновение лимфоидных узелков происходит на четвертом этапе, который проходит на фоне уменьшения количества диффузной лимфоидной ткани [266].
Лимфоидные узелки слизистых оболочек – это скопление клеток овальной или круглой формы, которые состоят из ретикулярной ткани (основы), образованной ретикулярными клетками, в которых содержатся лимфоциты, макрофаги и плазмоциты [265].
Ретикулярные клетки, вместе с ретикулярными волокнами, образуют строму лимфоидного узелка. При этом волокна расположены в такой закономерности, что образуют "корзину", подобную таковым в лимфатических узлах. В зрелом (реактивном) узелке выделяют центр размножения (герминативный центр) и периферию – мантию, образованную мелкими клетками – малыми лимфоцитами, которые формируют оболочку вокруг центра размножения. Кроме центра размножения и мантии во вторичных лимфоидных узелках выделяют субэпителиальную и околоузловую зоны. Околоузловая зона имеет лимфоцитообразующую функцию, которая в дальнейшем является началом образования лимфоидного узелка. Субэпителиальная зона или купол лимфоидного узелка непосредственно контактирует с энтероцитами.
В. Я Никитин с соавторами [473] доказывает, что состояние органов гемоиммунопоэза слизистых оболочек изменяется волнообразно. Каждый цикл состоит из 4 последовательных фаз: 1. Новообразование структур; 2. Дифференцирование и дозревание; 3. Функциональной активности и 4. Истощение и разрушение структур. Каждая фаза имеет свои морфологические особенности. В первую фазу каждого цикла оказывается бессистемное скопление лимфоидных клеток в органах гемоиммунопоэза. Во вторую фазу, с момента проникновения лимфоцитов в диффузную лимфоидную ткань, проходит размножение и дозревание (дифференцирование) лимфоцитов, которое оказывается образованием зон (центральные органы) или лимфоидных узелков (периферические) органы. В третью фазу изменяется соотношение корковой и мозговой зон в центральных органах, а в периферических – образование узелков со светлыми центрами. В четвертой фазе морфологические изменения выявляются в центральных органах гемоиммунопоэза увеличением мозговой зоны, а в периферической – в значительном уменьшения количество паренхиматозных структур, особенно разрушается структура лимфоидных узелков.
У телят суточного возраста в крови содержится, сравнительно большое количество лимфоцитов 4,5±0,2х109 г/л, в том числе Т-лимфоцитов – 63,4±2,7%; наименьшее В-лимфоцитов – 21,7±1,4%, а в сыворотке крови самой низкой уровень Іg - 1,4±0,2 г/л и сравнительно невысокая комплементарная (2,1±0,3 од.) и бактерицидная (33,8±1,7 од.) активность.
У новорожденных животных лимфоидные образования ассоциирующиеся со слизистыми оболочками, имеют определенную топографию и характеризуются сложной структурой, положительно коррелирующей с развитием слизистой оболочки трубкообразных органов.
Однако, следует отметить, что количество иммунокомпетентных структур в аппаратах внутренних органах не одинаковая. Они больше всего развитые в органах аппарата пищеварения, меньше – в аппарате дыхания и наименьшее их количество встречается в аппарате органов мочеотделения. Кроме того, в разных органах одного и того же аппарата они размещены в неодинаковом количестве и качестве.
Иммунокомпетентные структуры ассоциируемые со слизистыми оболочками трубкообразных органов разнообразные. Однако среди них следует выделить следующие образования: одиночные лимфоциты размещены в большом количестве среди клеток эпителия; диффузная лимфоидная ткань или же ее узелковая пластинка, что содержатся в толще слизистой оболочки.
Анатомически наиболее сформированными является миндалины, которые размещены на грани ротовой и носовой полостей и глотки, образовывая лимфоидное кольцо, или кольцо Пирогова – Валедера [181, 327, 328].
Выделяют парные небные и непарные небные, языковые, глоточные и околонадгортанные (у свиньи и овцы) миндалины. Анатомически миндалины ограничены соединительнотканной капсулой и являют собой скопление лимфоидной ткани в толще слизистой оболочки корня языка, мягкого неба и глотки. Некоторые из них (парная небная) значительно выступают в просвет глотки или же полностью находится в толще ее слизистых оболочек.
Присущим морфологическим признаком размещения миндалин является наличие на поверхности слизистой оболочки хорошо видимых ямообразных углублений – крипт. Слизистая оболочка в местах размещения миндалин образует синусы (слепо оканчивающееся впячивание) или же незначительные многочисленные ямки – крипты.
У новорожденных телят лимфоидная ткань небных и глоточных миндалин достигает 43-60% общей площади, а эпителий крипт – 20-23%. Лимфоидных узелков оказывается от 8 до 30% от общей площади диффузной ткани [124]. Строму миндалин образует ретикулярная ткань, которая заполняет все пространство, где размещена диффузная лимфоидная ткань, а также образует капсулы (корзины) лимфоидных узелков, которая указывает на функциональную их зрелость на данном этапе развития организма. В диффузной лимфоидной ткани языковых миндалин лимфоидные узелки не выявляются, а ретикулярная строма больше содержится возле эпителиальных крипт [327,328].
Парные небные миндалины у новорожденных телят являют собой округлые образования, которые расположены в рыхлой соединительной волокнистой ткани, значительно разветвленного синуса, отверстие которого размещено в боковых стенках слизистой оболочки глотки. Глоточные миндалины непарные, поликриптные, разветвленные и вместе с тем компактные образования [328].
У жеребят парные небные миндалины имеет вид продолговатого образования с множеством крипт, размещенных по сторонам от корня языка. Непарная небная миндалина (на мягком небе со стороны ротовой полости), языковая и трубная почти не выделяются на поверхности слизистой оболочки. У жеребят они имеют вид продолговатых узелков, которые выпираются над поверхностью слизистой оболочки с множеством крипт.
У новорожденных поросят парные небные миндалины имеют удлиненную листовидную форму с мелкими численными криптами. Такие же малые крипты выделяются и в надгортанной миндалине, которые содержатся по сторонам от надгортанно-язычных складок, как и у ягнят. Языковая миндалина на анатомическом уровне почти не определяется.
У щенков анатомически выделяются парные небные миндалины, которые имеют вид компактных продолговатых образований размещенных в складках слизистой оболочки боковых поверхностей глотки. Глоточные миндалины анатомически на поверхности слизистой оболочки не выделяются, а языковые – отсутствуют.
Миндалины новорожденных животных содержат ретикулярную строму, в петлях которой размещены лимфоциты. Лимфоидная ткань диффузна. Характерно, что среди нее определяются в незначительном количестве первичные лимфоидные узелки. Только у телят с высоким морфофункциональным статусом (90-100 баллов) в диффузной лимфоидной ткани небные миндалины оказываются лимфоидные узелки со светлыми центрами (табл. 21). Следовательно, миндалины новорожденных животных анатомически сформированы и имеют определенные соотношения стромальних и паренхиматозных структур. У недоразвитых животных значительно уменьшается площадь диффузной лимфоидной ткани, лимфоидные узелки оказываются в виде скоплений лимфоцитов.
Иммунокомпетентные структуры слизистой оболочки пищевода образованы отдельными скоплениями диффузной лимфоидной ткани, количество которой увеличивается в каудальном направлении. Лимфоидные узелки среди лимфоидной ткани, оказываются уже у новорожденных телят (суточных) и поросят. В толще слизистой оболочки животных содержатся также одиночные лимфоциты среди эпителиальных клеток, что больше характерно для щенков (имматуронатных животных).
В слизистой оболочке желудка, лимфоидные образования имеют характерные видовые особенности. У телят, в преджелудках (рубец, сетка, книжка) оказываются одиночные лимфоциты и незначительные скопления диффузной лимфоидной ткани. В сычуге количество лимфоидных образований значительно растет от кардия к пилорусу. В слизистой оболочке пилорической зоны сычуга у новорожденных телят оказываются среди диффузной лимфоидной ткани, одиночные и групповой первичные и вторичные лимфоидные узелки. У других видов животных они не выделяются на фоне лимфоидной диффузной ткани.
Однако на формирование первичных и вторичных лимфоидных узелков у суточных поросят указывает Е. Г. Прокушенкова (240). Автор в толще слизистой оболочки фундальной зоны желудка суточных поросят обнаруживает не только диффузную лимфоидную ткань, но и ее узелковую форму. Лимфоидные узелки, особенно вторичные, содержатся в подслизистом слое. Ретикулярная строма образует характерные "корзины" (рис. 53, 54).
Исследования Т. Р. Кораблевой [122, 123, 124, 126] показывают прямую зависимость между длиной определенной кишки, особенно тощей и подвздошной, и кишечными бляшками (табл. 22). Особенно большая длина лимфоидной бляшки, головка которой содержится на границе между слепой и подвздошной кишками, а верхушка достигает определенной части тощей кишки.
Таблица 22. Относительная площадь структурных компонентов небных миндалин телят новорожденного периода (Т. Р. Кораблева, 1994)
|
Возраст, |
Относительная площадь % |
||||
|
Капсула |
Трабекули |
ДЛТ* |
ЛВУ** |
Эпителий |
|
|
1 |
7,5±1,3 |
7,6±0,9 |
37,1±2,8 |
3,5±1,9 |
37,0±2,8 |
|
10 |
11,6±1,1 |
10,7±0,7 |
38,2±1,5 |
12,2±1,1 |
27,8±2,0 |
|
30 |
11,0±0,6 |
12,6±0,6 |
39,5±1,4 |
21,0±2,1 |
16,2±1,2 |
* ДЛТ – диффузная лимфоидная ткань; ** ЛВУ – лимфоидные узелки
У телят, до кормления молозивом, кишечные бляшки имеют вид зернообразных компактных выпячиваний на фоне бархатистой поверхности слизистой оболочки кишки (рис. 55). На микроскопическом уровне, такие кишечные бляшки окружены соединительной тканью, а в центре содержится значительное скопление лимфоцитов (рис. 56).
|
|
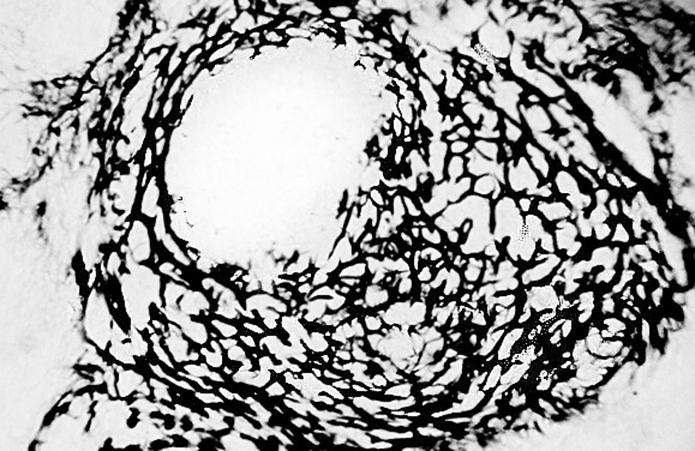
Рис. 53. Гистотопограмма дна желудка поросенка (сутки). Импрегнация серебром, МБИ-6, х80: 1 – ретикулярные волокна лимфоидного узелка; 2 – герминативний центр (Прокушенкова О. Г., 2005).
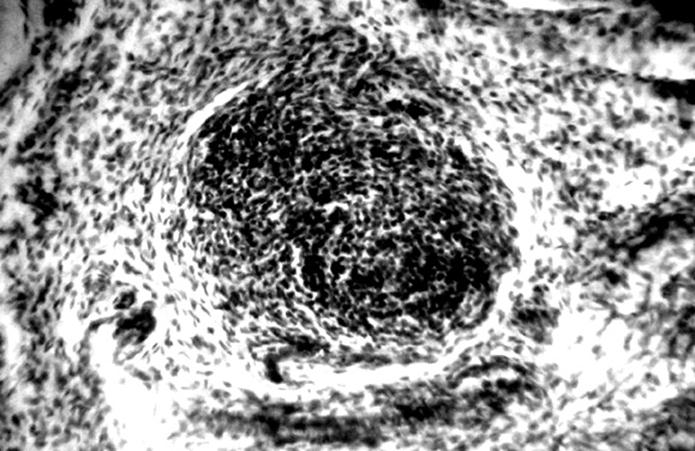
Рис. 54. Лимфоидный узелок малой кривизны желудка поросенка (сутки). Гематоксилин и эозин, МБИ-6, х80: 1 – лимфоидный узелок (Прокушенкова О. Г., 2005).
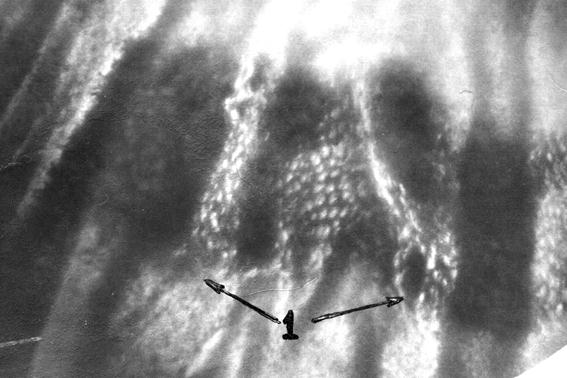
Рис. 55. Лимфоидная бляшка тощей кишки безмолозивной телочки (сутки). Макропрепарат. 1 – лимфоидная бляшка (Т. Р. Кораблева, 1998).
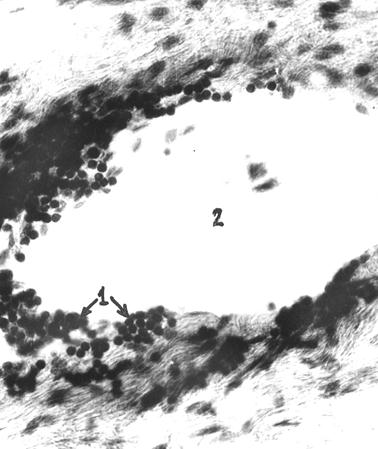
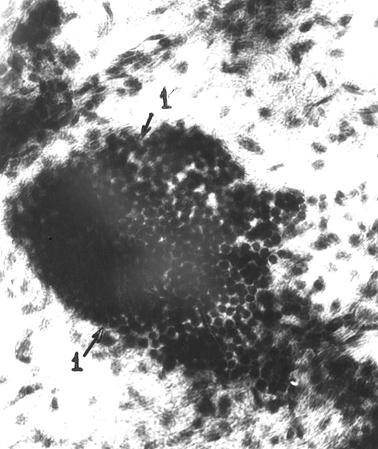
Рис. 56. Диффузная лимфоидная ткань лимфоидной бляшки тощей кишки безмолозивной телочки. 1 – диффузная лимфоидная ткань; 2 – просвет воронкообразной соединительнотканной основы бляшки (Т. Р. Кораблева, 1998).
Следовательно, иммунокомпетентные структуры новорожденных животных наиболее свойственны тонкой кишке, особенно каудальной части тощей и подвздошной кишкам (табл. 23). Т-лимфоциты с Y и S рецепторами размещенными в слизистой оболочке кишечника всех новорожденных животных. Кроме того, в толще слизистой оболочки оказывается как скопление лимфоидной ткани, так и одиночные или же группы лимфоидных узелков, которые образуют лимфоидные (кишечные) бляшки, которые размещены в толще слизистой оболочки или подслизистой основе.
Таблица 23. Длина отделов тонкого кишечнику и лимфоидных бляшек
телят новорожденного и молочного периодов (Т. Р. Кораблева, 1995)
|
№ |
Возраст, |
Длина, см |
||||
|
Двенадцатиперстная |
Пустая |
Подвздошная |
КЛБ* |
ЛБ** |
||
|
1 |
1 |
50,2±1,9 |
1731,0±66,7 |
56,7±5,5 |
129,6±9,8 |
128,3±14,6 |
|
2 |
10 |
51,8±1,9 |
1874,4±85,9 |
64,8±1,8 |
167,0±8,8 |
160,8±12,2 |
|
3 |
30 |
68,9±4,3 |
1849,5±70,6 |
69,3±7,7 |
195,0±9,7 |
163,9±17,2 |
* КЛБ – каудальная лимфоидная бляшка; **ЛБ – лимфоидная бляшка
В тонкой кишке, начиная с двенадцатиперстной кишки, количество лимфоидных образований увеличивается, они образуют целые скопления-бляшки разной длины и ширины. В двенадцатиперстной кишке новорожденных телят первая кишечная бляшка содержится на расстоянии 2-5 см от пилоруса. Количество лимфоидных бляшек достигает 3, они занимают 5-8% площади слизистой оболочки двенадцатиперстной кишки. Лимфоидные узелки оказываются в собственной пластинке слизистой оболочки и в подслизистой основе. Диффузная лимфоидная ткань размещена преимущественно между лимфоидными узелками. В тощей кишке их количество и величина значительно растут. На 1 см2 лимфоидной бляшки в подвздошной кишке находится 231-242 лимфоидных узелков, а в средней части тощей 200-218, тогда как в двенадцатиперстной – 170-294 (табл. 22).
Характерно, как доказывает Т. Кораблева [122-125], что самая длинная кишечная бляшка размещена в подвздошно-пустом участке тонкого отдела кишечника. Ее основа граничит со слепой, а верхушка достигает каудального участка тощей кишки так, что длина бляшки у новорожденных жеребят, телят и поросят колеблется от 1,5 до 2,5 метров.
В толстой кишке их скопления больше оказывается в слепой несколько меньше в ободочной и увеличивается в прямой (табл. 23). Однако в толстой кишке оказываются как одиночные лимфоидные узелки, так и их скопления. В начальной части ободочной кишки на 1 см2 содержится 52– 60 лимфоидных узелков. В каудальном направлении их количество уменьшается до 1–28 (табл. 24-27). В прямой кишке лимфоидные бляшки размещены за 5–8 мм от анального отверстия.
Таблица 23
Количество одиночных лимфоидных узелков в слизистой
оболочке двенадцатиперстной кишки телят новорожденного
и молочного периодов (Т. Р. Кораблева, 1997)
|
Возраст, |
Количество лимфоидных узелков |
||
|
Двенадцатиперстная кишка, средняя часть |
Пустая |
||
|
Средняя часть |
Каудальна часть |
||
|
1 |
4,04±0,2 3,4–4,6 |
2,96±0,05 2,8–3,1 |
3,20±0,10 2,9–3,5 |
|
10 |
5,90±0,30 5,2–6,9 |
4,20±0,22 3,6–4,8 |
4,14±0,07 4,0–4,4 |
|
30 |
6,04±0,58 5,9–7,3 |
5,70±0,16 5,2–6,1 |
4,30±0,7 3,9–5,3 |
|
120 |
7,42±0,27 6,7–8,1 |
6,30±0,50 4,7–7,5 |
3,96±0,11 3,6–4,2 |
Таблица 24. Количество одиночных лимфоидных узелков в слизистой оболочке слепой кишки телят новорожденного и молочного периодов на 1 см2 (Т. Р. Кораблева, 1997)
|
Возраст, |
Количество лимфоидных узелков |
|
|
В средней части |
В участке купола |
|
|
1 |
0,80±0,10 0,50–1,10 |
1,34±0,20 0,80–1,90 |
|
10 |
0,82±0,20 0,30–1,13 |
1,74±0,30 1,00–9,40 |
|
30 |
1,52±2,20 1,20–2,10 |
2,21±0,18 1,90–2,90 |
|
40 |
2,92±0,10 2,60–3,20 |
2,44±0,30 1,70–3,30 |
Таблица 25. Количество одиночных лимфоидных узелков в слизистой оболочке ободочной кишки телят новорожденного и молочного периодов (Т. Р. Кораблева, 1997)
|
Возраст, |
Количество лимфоидных узелков, шт |
|
|
В проксимальной части |
В средней части |
|
|
1 |
52,80±2,80 45,0–60,0 |
5,20±1,50 1,0–9,0 |
|
10 |
56,0±5,30 43,0–73,0 |
9,0±1,87 – |
|
30 |
64,0±2,40 56,0–70,0 |
12,20±1,42 8,0–16,0 |
|
120 |
65,80±44,0 52,0–78,0 |
72,60±0,80 10,0–15,0 |
Таблица 26. Параметры лимфоидных бляшек и количество лимфоидных узелков слепой кишки телят новорожденного и молочного периодов (Т. Р. Кораблева, 1997)
|
Возраст, |
Размеры бляшек |
Количество лимфоидных узелков на 1 см2 |
|
|
Длина, мм |
Ширина, мм |
||
|
1 |
1,5–4,0 |
1,0–5,5 |
71,40±8,21 47,0–94,0 |
|
10 |
1,3–4,3 |
0,9–4,0 |
73,80±6,50 51,0–89,0 |
|
30 |
2,7–3,8 |
2,7–4,1 |
87,80±4,84 76,0–104,0 |
Таблица 27. Параметры лимфоидных бляшек и количество лимфоидных узелков проксимальной части ободочной кишки телят новорожденного и молочного периодов (Т. Р. Кораблева, 1997)
|
Возраст Суток |
Размеры бляшек |
Количество лимфоидных |
|
|
Длина, мм |
Ширина, мм |
||
|
1 |
2,70–3,90 |
4,80–5,70 |
54,40±2,73 45,0–60,0 |
|
10 |
5,30–7,20 |
5,40–6,60 |
60,40±2,71 53,0–6,90 |
|
30 |
5,00–9,70 |
5,70–7,10 |
80,20±6,64 60,0–97,0 |
Наличие и степень развития кишечных бляшек можно обнаружить визуально [122-125]. Для этого кишечник разрезают по малой кривизне (со стороны закрепления брыжейки), освобождают от содержимого и осматривают под бинокулярной лупой. На ее слизистой оболочке оказываются утолщения с многочисленными криптами (рис. 57, 58). Степень развития лимфоидных образований, прямым путем, коррелирует со степенью развития эпителиальной ткани слизистой оболочки кишечника.
Взаимодействие лимфоидных структур подтверждает феномен гетерогенности и коррелятивной взаимосвязи [124]. Степень развития лимфоидных образований слизистых оболочек кишечника зависит от взаимоотношений в системе мать–плацента–плод, а также способностью плода потреблять околоплодную жидкость, которая предопределяет образование первородного кала (мекония) у всех млекопитающих.
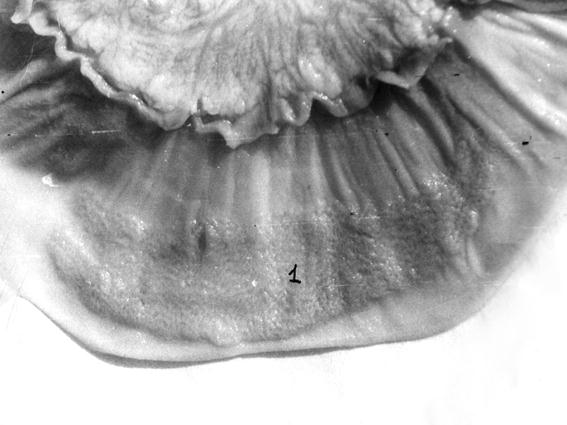
Рис. 57. Средние участки тощей кишки теленка (сутки). Макропрепарат (Т. Р. Кораблева, 1995). 1– лимфоидная бляшка.
В тонкой кишке жеребят содержится 80-100 кишечных бляшек. Они оказываются в двенадцатиперстной, где достигают длины 1-5 см и ширины 1,5 см. Наибольшая бляшка содержится в подвздошной кишке, длина которой достигает 17-38 см. У поросят подвздошно-пустая – достигает 1,15-2,2 м, у новорожденных телят – до 2,4 м и щенков – 10-40 см.
Значительное количество диффузной лимфоидной ткани в виде одиночных лимфоидных узелков содержится у новорожденных млекопитающих в слизистых оболочках дыхательных и мочеполовых органов.
Следует отметить, что количество и степень развития иммунокомпетентных структур со слизистыми оболочками находится в прямой зависимости от пренатального развития всего организма, а также от антигенного стимула стартовыми антигенами молозива.
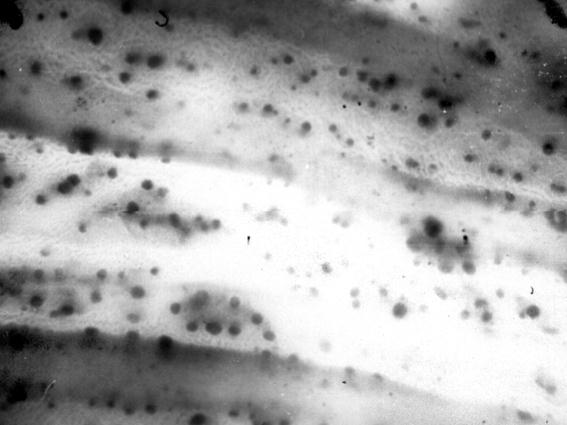
Рис. 58. Одиночные лимфоидные узелки ободочной кишки теленка (сутки). Макропрепарат (Т. Р. Кораблева, 1999).
На тканевом уровне кишечная бляшка подвздошной кишки образована из плотно размещенных продольно вытянутых лимфоидных узелков, верхушки которых выступают между микроворсинками слизистой оболочки, а основа – в подслизистой на границе с мускульной оболочкой (рис. 59). Лимфоидные узелки образованы из плотноразмещенных лимфоцитов так, что их стромальные структуры не просматриваются. Однако, у суточных телят, погибших от нарушения функции органов пищеварения, происходит определенное "выселение" лимфоцитов и на "границе" лимфоидного узелка оказывается и его ретикулярная строма (рис. 60). Учитывая это, можно допустить, что акцедентальная трансформация присуща не только тимусу, но и другим лимфоидным образованием [102, 105, 106].
По данным Т. Р. Кораблевой [123, 126] лимфоидные узелки в ободочной кишке суточных телят больше по размеру и размещаются среди диффузной лимфоидной ткани (рис. 61). Автор также доказывает, что у суточных телят оказываются лимфоидные узелки в прямой кишке и имеют вид слоистых образований, которые содержатся в толще слизистой оболочки (рис. 62).
Т. Р. Кораблева обнаружила определенную топографическую зависимость размещения кишечных бляшек по всей длине кишечника (рис. 65). Поражает неравномерность их размещения. Так наибольшее их количество (особенно узелковой лимфоидной ткани) содержится в подвздошной и каудальной части тощей кишки. В краниальном направлении их количество уменьшается, однако увеличивается объем диффузной лимфоидной ткани. В слепой кишке наибольшее количество кишечных бляшек содержится в ее верхушке, а в ободочной – одиночные по всей длине, тогда как в прямой выявляются скопления только в ее каудальном участке.
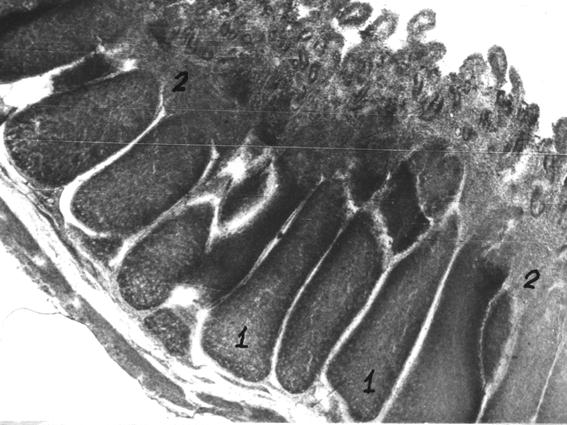
Рис. 59. Лимфоидные узелки подвздошной кишки суточного теленка (сутки) (Т. Р. Кораблева, 1999)
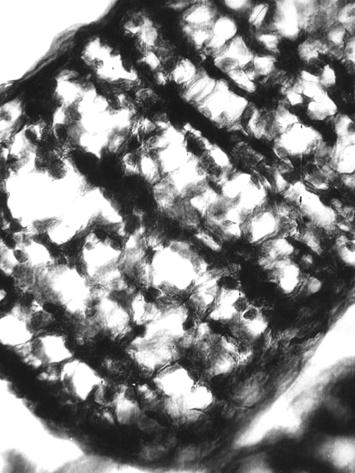
Рис. 60. Ретикулярная строма лимфоидного узелка суточного теленка (сутки), погибшего от заболевания диспепсии (Кораблева Т. Р., 1999).
Автор обнаружила, что в слепой кишке на границе впадения подвздошной содержится достаточно большая (определяется визуально) кишечная бляшка (рис. 60.).
В прямой кишке такие большие по размеру кишечные бляшки содержатся возле анального отверстия (рис. 61). Следует отметить, что плотность размещения лимфоидных узелков по длине тонкой и толстой кишок телят неодинакова (рис. 62). С возрастом телят (в 30-суточных) плотность лимфоидных узелков в слизистой оболочке кишок растет в каудальном направлении.
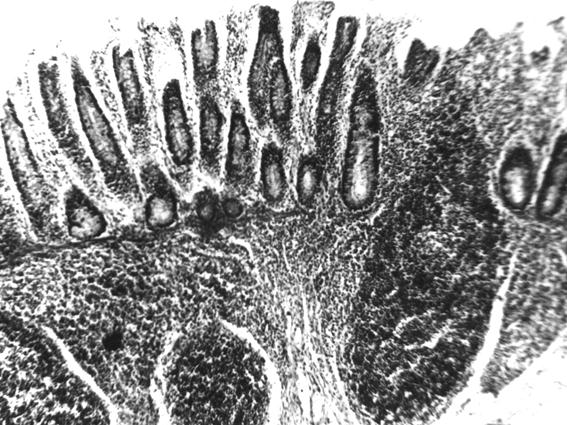
Рис. 61. Лимфоидные узелки проксимального участка ободочной кишки теленка (сутки) (Т. Р. Кораблева, 1995)
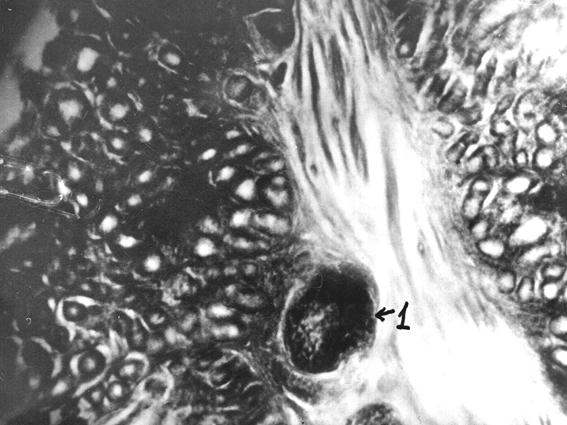
Рис. 62. Лимфоидный узелок дистального участка прямой кишки теленка (сутки) (Т. Р. Кораблева, 1999).
Т. Р. Кораблева, на гистологическом уровне, обнаружила закономерность замещения в кишечных бляшках диффузной лимфоидной ткани на лимфоидные узелки (рис. 65-67) в каудальном направлении. Наибольшее количество их находится в подвздошной кишке суточных телят, тогда как в 120-суточных – значительно растет в полой и двенадцатиперстной.
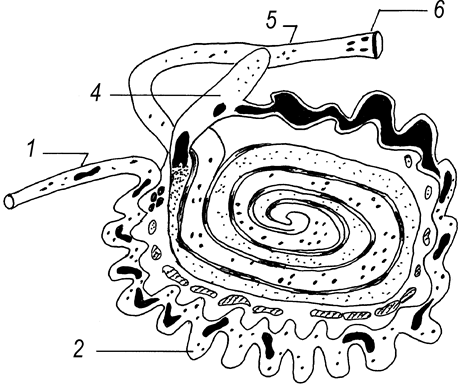
Рис. 63. Топография лимфоидных образований тонкой и толстой кишок телят новорожденного и молочного периодов (Т. Р. Кораблева, 1997): ![]() – одиночные лимфоидные узелки;
– одиночные лимфоидные узелки; ![]() – лимфоидные бляшки;
– лимфоидные бляшки; ![]() – брыжеечные лимфатические узлы; кишки: 1 – двенадцатиперстная; 2 – пустая; 3 – подвздошная; 4 – слепая; 5 – ободочная; 6 – прямая кишка.
– брыжеечные лимфатические узлы; кишки: 1 – двенадцатиперстная; 2 – пустая; 3 – подвздошная; 4 – слепая; 5 – ободочная; 6 – прямая кишка.
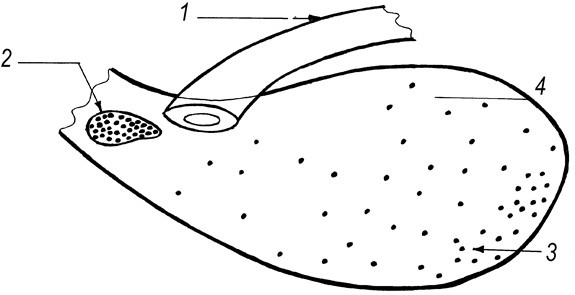
Рис. 64. Топография скоплений и одиночных лимфоидных узелков слизистой оболочки слепой кишки телят новорожденного и молочного периодов (Т. Р. Кораблева, 1993).
Следовательно, исследование иммунокомпетентных образований ассоциируемых со слизистой оболочкой кишечника суточных телят свидетельствуют, что они в определенной мере сформированы. Первое кормление молозивом вызывает значительный их рост и увеличение в них лимфоцитов, что предопределяется стартовым антигеном – иммуноглобулинами молозива. Важен также факт возможности акцидентальной трансформации кишечных бляшек при нарушении функции органов пищеварения. Кроме этого, подытоживая особенности морфогенеза лимфоидных образований слизистой оболочки кишечника новорожденных животных, можно допустить, что они в определенной мере способны на ответ при действии антигенных факторов, Как структуры местного иммунитета.
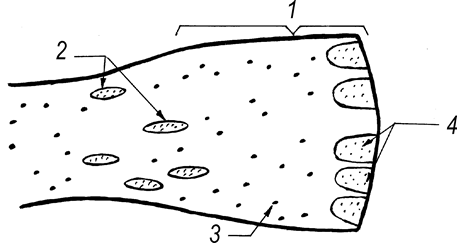
Рис. 65. Топография скоплений и одиночных лимфоидных узелков слизистой оболочки прямой кишки телят новорожденного и молочного периодов (Т. Р. Кораблева, 1993) : 1 – выходная часть прямой кишки; 2 – лимфоидные бляшки; 3 – одиночные лимфоидные узелки; 4 – лимфоидные бляшки выхода.
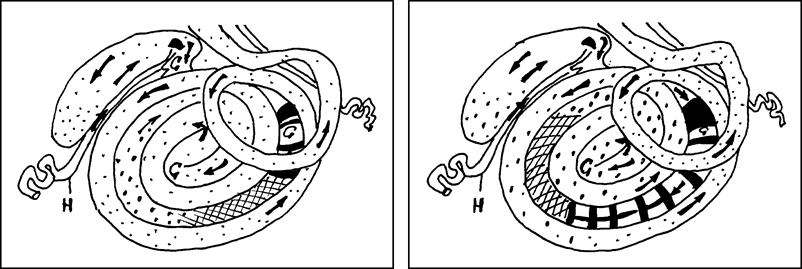
Рис. 66. Плотность размещения лимфоидных узелков слизистой оболочки толстой кишки 1- и 30-суточного возраста (Т. Р. Кораблева, 1994): ![]() – 45-65 /см2;
– 45-65 /см2; ![]() – 30-40 /см2;
– 30-40 /см2; ![]() – 15-25 /см2;
– 15-25 /см2; ![]() – 10-15 /см2;
– 10-15 /см2; ![]() – 1-9 /см2.
– 1-9 /см2.
У новорожденных млекопитающих определенное количество диффузной лимфоидной ткани содержится не только в слизистой оболочке трубчатых органов, но и в почках, печени и коже. Доказано, что они принимают участие в кооперации иммунной защиты организма.
Особенного внимания, как иммунокомпетентная структура, заслуживает печень. Эта большая застенная железа средней кишки хранит, в постнатальном онтогенезе животных, некоторые иммунокомпетентные функции и имеет характерные только для нее структуры, состояние которых в значительной мере определяет активность всей иммунной системы.
Через вену ворот печень связана с органами пищеварения, поджелудочной железой и селезенкой и влияет на их функциональную активность. Иммунокомпетеность печени значительно определяется звездчатыми ретикулоэндотелиальными клетками, которые составляют 20-30% всех клеток, которые устилают синусоидные капилляры и являются типичными макрофагами, способными в значительной мере модифицировать иммунный ответ на чужеродные вещества. Кроме того, в печенке, определенное время, сохраняются “дремлющие” эмбриональные ствольные клетки. Печень также влияет на иммунологический статус организма, который связан с изменением ее секреторной, экскреторной и дезинтоксикационной функций. В свою очередь функции печени непосредственно зависят от морфофункционального состояния желудка и кишечника (их иммунокомпетентных структур). Следует отметить, что короткий ствол вены ворот образуется путем слияния желудочно-селезеночной, краниальной и каудальной брыжеечных вен, проходит тело и входит в ворота печени, где разветвляется на междольковые вены, а затем на капилляры печеночных частиц. В частицах капилляры вливаются в центральную вену (венулу) частицы. Это начальные вены, которые отводят кровь от печени в каудальную полую вену. Благодаря наличию такой "чудесной" венозной сетки, кровь, которая будет оттекать от желудка и кишок очищается от токсинов и других вредных веществ. Кроме того, печень использует до 80% кислорода и питательных веществ крови вены ворот и только 20% – печеночной артерии. Особенности структуры печени и ее сосудов отмечаются у новорожденных млекопитающих сравнительно с взрослыми животными [174, 196, 200]. Печень прикрепляется связками к диафрагме, интенсивные сокращения которой во время вдоха и выдоха непосредственно связаны с реализацией генетической потребности в локомоции (см. 3.5.1.3.1.1. Печень).
Значительное место в иммуногенезе организма занимает брюшина и ее производные. Доказано, что большой сальник, который имеет вид “передника”, образованного складками брюшины, которые идут от большой кривизны желудка у жеребят, поросят и щенков и из левой продольной борозды рубца и большой кривизны сычуга у телят, отделяет от париетальной брюшины кишечник и поднимается к правой почке. Несколько меньше сальник развитой у жеребят.
У новорожденных животных он имеет вид прозрачной оболочки, которая пронизана кровеносными сосудами, вокруг которых размещено небольшое количество жировых отложений. Гистологическое строение сальника имеет определенные особенности. Между двумя листками брюшины содержится ретикулярная ткань, в которой оказывается хорошо развитая капиллярная сетка кровеносных сосудов и отдельные скопления лимфоидной ткани (молочные пятна). В местах скопления лимфоидной ткани базальная мембрана под мезотелием отсутствует, что и предопределяет свободное проникновение лимфоцитов, плазмоцитов и недифференцированных мезенхимобластов в брюшную полость. Лимфатические сосуды большого сальника и брюшины, которая размещается на диафрагме, сливаются и образуют большие коллекторы (450-1500 мкм), которые являются доказательством интенсивного обмена жидкости в брюшной полости. Следовательно, большой сальник обеспечивает иммунологическую реактивность брюшной полости и органов, которые размещаются в ней.
Лимфоидные образования характерны и для слизистой оболочки органов дыхания, после рождения животных, среди мирцательного эпителия содержатся малые и средние лимфоциты. Кроме того, оказываются их скопления в виде диффузной лимфоидной ткани или ее узелковой формы. Лимфоидные узелки имеют вид округлых или овальных скоплений лимфоцитов. В толще слизистой оболочки трахеи и в участке ее бифуркации содержатся одиночные лимфоидные узелки с маргинальной зоной. В слизистой оболочке самих бронхов также встречаются как одиночные лимфоциты, так и их скопления.
Образования лимфоидной ткани как диффузной, так и узелковой формы размещаются в слизистых оболочках органов мочеотделения. В толще слизистой оболочки мочевого пузыря содержатся скопление диффузной лимфоидной ткани и одиночные лимфоидные узелки несколько сферической формы. В участке пузырного треугольника оказываются скопления, большие по размеру, овальной формы. В слизистой оболочке мочевыводящих путей встречаются одиночные лимфоциты среди эпителиоцитов, отдельные скопления диффузной лимфоидной ткани и лимфоидные узелки, количество которых растет в каудальном направлении.
Лимфоидные образования, ассоциируемые со слизистыми оболочками полового аппарата почти не исследованы у новорожденных животных. Однако известно, что у новорожденных животных они чаще всего оказываются в толще слизистой оболочки матки и влагалища. Размеры и количество диффузной и узелковой формы значительно меньше сравнительно с другими трубкообразными органами.
Л. В. Чернишенко [346] показывает, что кроме лимфоидных образований, ассоциируемых со слизистыми оболочками, в организме животного и человека существуют периваскулярные лимфоидные узелки, которые имеют особенное строение и динамику морфологических превращений с возрастом. Автор показывает, что периваскулярные лимфоидные узелки, которые размещаются вокруг мелких сосудов, особенно микроциркуляции, генетически детерминированные и образуют единственную систему быстрого ответа на антиген, который циркулирует в крови или лимфе, активно регулируя иммунный гомеостаз.
Периваскулярные лимфоидные узелки образуются вокруг кровеносных сосудов, сначала в виде скоплений лимфоидных клеток, которые в последующем трансформируются в лимфоидные узелки с центрами размножения и своеобразной сосудистой сеткой. Эти узелки, как отмечает автор, являются структурными единицами иммунной системы и реагируют при попадании антигена парентерально. Автор указывает, что они формируются еще в пренатальном онтогенезе появляются вдоль разветвления сосудов микроциркуляторного русла почти во всех тканях органов, их систем и аппаратов, что доказывает об их активном участии при рециркуляции лимфоцитов.
Проведена нами исследования органов гемоиммунопоэза новорожденных (суточных) телят и поросят и данные Л. В. Чернишенко [346] показывают, что скопление лимфоцитов вокруг мелких кровеносных сосудов в соединительнотканной строме, совпадают по структуре с периваскулярними лимфатическими узелками. В костных органах суточных телят наблюдаются скопления лимфоцитов вокруг венул, а несколько большие по размеру – мелких артерий (рис. 67-70). Такие образования наиболее характерны для пренатальных недоразвитых животных. Образование скоплений лимфоцитов, на наш взгляд, побуждает нарушение плацентарного барьера, предопределяя проникновение материнских белков через структуры фетальной части плаценты. Возможно, материнские белки, которые проникают, через плаценту в кровь плода вызывают соответствующую реакцию иммунокомпетентных структур, что постепенно приводит к сенсибилизации. При кормлении молозивом в сенсибилизированный организм поступает значительное количество материнских белков, которые приводят к возникновению аллергической реакции разного типа. Мнение о том, что с возрастом животных, образования скоплений лимфоцитов вокруг мелких кровеносных сосудов, связанных с попаданием антигенов в кровь, совпадают с мнением Л. В. Чернишовой [346] об их кооперативной функции определения их иммунокомпетентности внутренней среды и рециркуляции лимфоцитов.
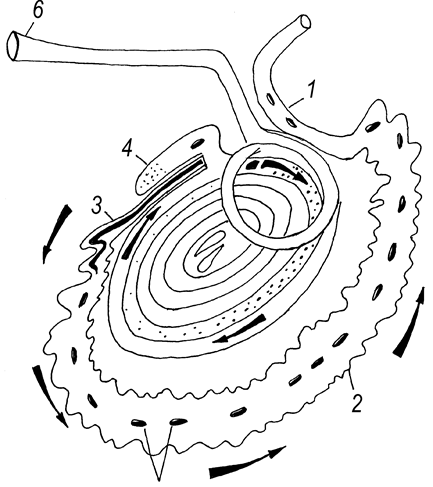
Рис. 67. Направление замещения диффузной лимфоидной ткани на узелковую форму тонкой и толстой кишки телят новорожденного и молочного периодов (Т. Р. Кораблева, 1996). Кишки: 1 – двенадцатиперстная; 2 – тощая; 3 – подвздошная; 4 слепая; 5 – ободочная; 6 – прямая. Стрелками показано направление замещения.
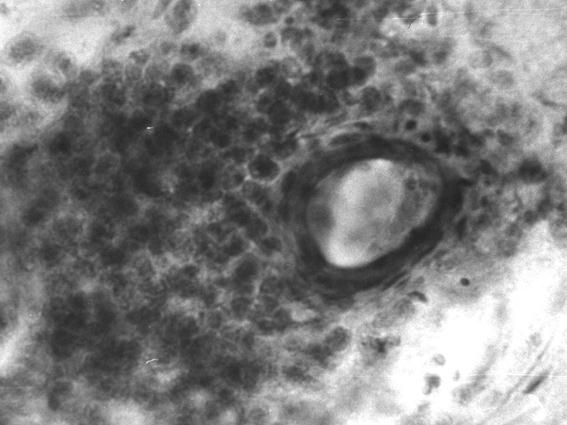
Рис. 68. Скопление лимфоцитов вокруг мелкой артерии компактной костной ткани копытцевой кости теленка (сутки). Гематоксилин и эозин, МБИ-6, х400..
Следовательно, у неонатальных млекопитающих наиболее зрелыми и функционально завершенными являются центральные органы иммунной системы: костные органы (красный костный мозг) и тимус. В отличие от незрелой стромы костных органов, клетки красного костного мозга характеризуются морфологической завершенностью и способны активно принимать участие в становлении иммунной системы новорожденного организма. Однако структурные особенности костных органов предопределены зрелорождаемостью организма, которые более зрелыми являются у жеребят и телят, несколько меньше – у поросят и менее всего – у щенков.
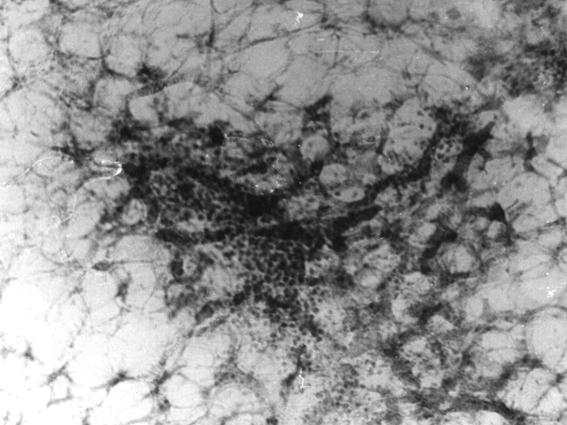
Рис. 69. Скопление лимфоцитов вокруг мелких кровеносных сосудов костно-мозгового участка венечной кости теленка (сутки). Гематоксилин и эозин, МБИ-6, х80.
Значительного развития достигает тимус. Паренхима тимуса делится на корковую и мозговую зоны. Соотношение этих зон колеблется от 1:1,5 до 1:3,5, что определяется пренатальным развитием животных.
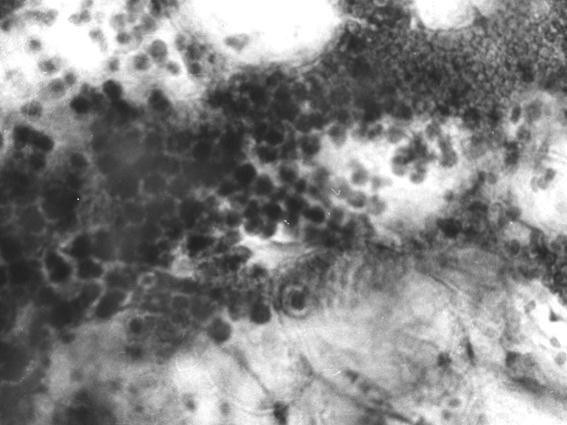
Рис. 70. Скопление лимфоцитов вокруг венул костного мозга путовой кости теленка (сутки). Гематоксилин и эозин, МБИ-6 х400.
Среди паренхиматозных лимфоидных органов наиболее выраженное анатомическое строение имеет селезенка, что, возможно, связано с ее функцией иммунологического контроля внутренней среды и непрямого действия внешних факторов.
Периферические органы (лимфатические узлы, лимфоидные структуры ассоциируются со слизистыми оболочками трубчатых органов) стратегически распределены на местах возможного проникновения чужеродных агентов из внешней среды сразу после рождения, и имеющие наибольшую морфологическую незавершенность.
В новорожденный период, в результате антигенной стимуляции, в лимфатических узлах растет количество лимфоидной ткани, особенно ее узелковой формы. Это свидетельствует о значительной их реактивности в ответ на действие чужих органических белков. Однако у недоразвитых животных трансформация лимфоидной ткани на узелковую значительно задерживается во времени, которое приводит к возникновению болезней, возбудителями которых являются даже условно патогенные микроорганизмы.
Морфофункциональное состояние иммунокомпетентных структур неонатальных млекопитающих имеет особенности как на анатомическом, так и субклеточному уровнях. Уменьшения показателей иммунной защиты на субклеточном (молекулярном) уровне определяют как иммунодефиците. У неонатальных млекопитающих состояние иммунной системы представляется особенностями их естественной резистентности (табл. 29).
Следует отметить, что отсутствие в крови новорожденных млекопитающих иммуноглобулинов (Ig) не совсем верно. Под названием Ig объединяют все белки, которые имеют аналогичное молекулярное строение характерное для антител, независимо от биохимических и биофизических свойств (Ф. Хорш, 1977). В зависимости от структуры постоянной части тяжелых цепей молекул, Ig разделяют на три класса IgА, IgМ и IGG. IgМ, и отличаются выраженной способностью к агглютинации, гемолизу, бактериолизу, а также к опсонизации, не нейтрализуют токсины. IGG, напротив, преимущественно нейтрализуют токсины и вирусы. IgА, в отличие от предыдущих классов Ig, неспособны к связыванию комплемента. В общих чертах принято, что иммуноглобулинам принадлежит ведущая роль в местной иммунной реакции в разных полостях (желудке, кишечнике, органах дыхания, конъюнктивном мешке) организма животных.
Таблица 29 Показатели неспецифической резистентности неонатальных телят при разной степени внутриутробного развития (В. И. Левченко, 1998)
|
Показатели |
Возраст, |
Развитые телят (клинически здоровые) |
Недоразвитые (гипотрофики) |
Р< |
|
Лейкоциты, г/л |
1 |
6,54±0,17 |
4,26±0,03 |
0,001 |
|
Lim |
3,90–8,50 |
3,10–6,70 |
||
|
5 |
6,57±0,13 |
5,21±0,10 |
0,01 |
|
|
Lim |
4,00–8,40 |
4,00–6,80 |
||
|
10 |
7,36±0,14 |
5,62±0,11 |
0,001 |
|
|
Lim |
6,00–8,70 |
3,70–6,90 |
||
|
20 |
7,68±0,11 |
6,24±0,10 |
0,001 |
|
|
Lim |
6,20–8,80 |
4,00–7,50 |
||
|
ФА % |
1 |
45,00±0,80 |
32,00±0,95 |
0,001 |
|
Lim |
37,00–55,00 |
19,00–43,00 |
||
|
5 |
50,00±0,66 |
36,00±0,72 |
0,001 |
|
|
Lim |
43,00–56,00 |
23,00–47,00 |
||
|
10 |
54,00±0,50 |
42,00±0,90 |
0,001 |
|
|
Lim |
47,00–60,00 |
31,00–57,00 |
||
|
20 |
57,00±0,40 |
47,00±0,70 |
0,001 |
|
|
Lim |
52,00–60,00 |
39,00–59,00 |
||
|
Иф, мкл. л |
1 |
5,60±0,13 |
5,60±0,14 |
0,001 |
|
Lim |
4,30–8,40 |
4,10–7,80 |
||
|
5 |
6,30±0,13 |
5,90±0,14 |
– |
|
|
Lim |
4,70–8,90 |
4,10–7,80 |
||
|
10 |
6,60±0,16 |
6,5±0,14 |
0,5 |
|
|
Lim |
5,20–9,18 |
4,80–8,80 |
После рождения теленок растет и количество, ![]() и белков, а особенно –глобулинов, после первого кормления молозивом, что свидетельствует об антигенной стимуляции иммунокомпетентных структур белками молозива.
и белков, а особенно –глобулинов, после первого кормления молозивом, что свидетельствует об антигенной стимуляции иммунокомпетентных структур белками молозива.
Большинство исследователей (особенно клиницистов) доказывают, что новорожденные животные получают Ig только за счет Ig молозива [190, 191].
В организме телят при рождении находятся иммуноглобулины, количество которых значительно растет после кормления молозивом. Возможно, иммуноглобулины молозива являются стартовым антигеном, который стимулирует образование собственных антител (табл. 30, 31). У телят после рождения в крови содержится определенное количество белков, в том числе, ![]() и
и ![]() . Первое кормление молозивом побуждает рост их количества, особенно
. Первое кормление молозивом побуждает рост их количества, особенно ![]() глобулинов, что свидетельствует об антигенной стимуляции иммунокомпетентных структур белками молозива.
глобулинов, что свидетельствует об антигенной стимуляции иммунокомпетентных структур белками молозива.
В. П. Надточий [190], досказывает, что у новорожденных телят Т-хелперов содержится до 12-25% (табл. 32), тогда как у клинически больных их количество значительно уменьшается. В. І. Блинов [38] обнаруживает определенное количество альбуминов и глобулинов у новорожденных телят (табл. 33) и в течение 5 суток жизни телят их количество значительно растет, особенно - глобулинов (до 0,6-2,0).
Таблица 30. Концентрация белков в сыворотке крови телят до и после употребление молозива % (Дж. Х.Б. Рой, 1973)
|
Период |
Альбу- |
Глобулины |
Литература |
||||
|
|
|
|
|
|
|||
|
При рождении (до |
52 57 63 49 |
1 |
20 37 27 41 |
– – 10 |
16 6 8 9 |
0,8 0,0 1,4 1,3 |
Jameson E., et al., 1942, Pirse A. E., 1955 Hansen R. E. 1947 |
|
Сутки после отела |
38 |
30 |
– |
10 |
22 |
Hansen R. E. 1947 |
|
|
Полтора суток после |
30 |
22 |
– |
7 |
42 |
Jameson E., et al., 1942 |
Таблица 31. Белковый состав сыворотки крови телят черно-рябой породы (В. Д. Холод, Л. Н. Букос, 1998)
|
Показатель |
Сутки |
|||
|
Первые |
Вторые |
Пятые |
Десятые |
|
|
Общий белок, г/л |
51,50±0,45 |
58,60±0,66 |
55,40±0,95 |
52,10±0,45 |
|
Ig G, г/л |
8,22±0,24 |
9,05±0,20 |
9,07±0,28 |
10,26±0,29 |
|
Ig М, г/л |
2,13±0,06 |
2,42±0,07 |
2,56±0,07 |
2,62±0,10 |
|
Ig А, г/л |
3,12±0,08 |
3,21±0,08 |
2,97±0,07 |
3,14±0,08 |
|
Ингибитор трипсина, г/л |
21,5±0,10 |
2,33±0,05 |
1,78±0,14 |
1,00±0,10 |
Таблица 32. Динамика Т-хелперов (с тестом Ea – РУК) у клинически здоровых и больных пренатальной гипотрофией телят % (В. П. Надточий, 1998)
|
Возраст, |
Биометрический |
Клинически |
Больные |
|
1 |
Lim M±m |
12-25 21,0±0,5 |
9,5-23 17,6±0,54 |
|
5 |
Lim M±m |
16,5-26,0 22,0±0,5 |
10,5-23,0 18,1±0,59 |
|
10 |
Lim M±m |
13-24 19,6±0,5 |
10,8-23,0 16,5±0,56 |
|
20 |
Lim M±m |
17-26 23,6±0,5 |
13,5±25,0 21,3±0,46 |
В работах П. І. Головача [72] установлено, что определенный состав крови связан со скоростью оседания эритроцитов, который изменяется с возрастом животных [32].
Таблица 33. Концентрация альбумина, -, - и - глобулина в сыворотке крови телят (В. І. Блинов, 1985)
|
Возраст, суток |
Фракции белков в сыворотке крови, г/л |
|||
|
Альбумины |
Глобулины альфы |
Глобулины беты |
Гама-глобулины |
|
|
При рождении |
2,1–2,5 |
1,2–1,6 |
0,5–0,7 |
0,1–0,3 |
|
1–5 |
1,9–2,5 |
1,1–1,5 |
0,7–1,3 |
0,6–2,0 |
|
6–10 |
2,1–2,5 |
1,0–1,2 |
0,9–1,3 |
0,4–1,6 |
|
11–15 |
2,2–2,6 |
0,8–1,2 |
0,7–1,1 |
0,3–1,3 |
Защиту новорожденных от микроорганизмов внешней окружающей среды природа обеспечила неспецифическими факторами: неспецифическим прирожденным, а затем и приобретенным иммунитетом. У новорожденных телят естественная неспецифическая защита осуществляется в основном клеточными факторами, которые обладают фагоцитарною активностью микро - и макрофагов, окончательное формирование которых завершается в 6 месячном возрасте. Гуморальные факторы выражены недостаточно, особенно низкая лизоцима и бактерицидная активность. В следующие 2-3 недели жизни у телят быстро растет титр агглютининов [113].
Таблица 34. Морфологический состав крови и скорость оседания эритроцитов (СОЭ) у телят украинской черно-рябой породы (П. І. Головач, 2004)
|
Возраст, |
Гематокритный показатель |
Эритроциты 10 /л |
Гемог Лобин, г/л |
Цветной показатель |
Лейкоциты 10 /л |
Тромбоциты, 10 /л |
ШОЕ Мм/год |
|
1 |
48,3±1,6 |
7,2±0,3 |
152,3±7,1 |
1,06±0,05 |
14,3± 0,6 |
231,8±11,5 |
0,39±0,07 |
|
30 |
41,5±1,3 |
6,1±0,2 |
127,3±4,6 |
1,04± 0,03 |
10,4± 0,5 |
315,4±12,3 |
0,83±0,06 |
|
90 |
40,3±1,7 |
5,8±0,4 |
111,5±2,7 |
0,96±0,05 |
9,2±0,4 |
341,7±18,5 |
0,83±0,06 |
Таблица 35
Клеточный и гуморальный статус иммунной системы телят украинской черно-рябой породы (П. І. Головач, 2004)
|
Возраст, |
Лимфоциты 10/л |
Т-лимфоциты % |
В-лимфоциты% |
Фагоцитарная активность лейкоцитов % |
Ig, г/л |
Бактерицидная активность сыворотки крови % |
Лизоцимная активность сыворотки крови % |
Комплементарная активность сыворотки крови, Од. |
|
1 |
4,5±0,2 |
63,4±2,7 |
21,7±1,4 |
45,1±2,3 |
1,4±0,2 |
33,8±1,7 |
24,7±1,5 |
2,1±0,3 |
|
30 |
5,1±0,2 |
60,1±3,5 |
28,4±1,7 |
51,9±1,8 |
9,1±1,3 |
55,1±2,6 |
25,2±1,6 |
6,9±0,7 |
|
90 |
5,2±0,3 |
59,3±3,1 |
31,9±1,5 |
53,7±2,6 |
9,4±0,5 |
68,4±2,1 |
26,1±1,7 |
9,7±1,1 |
Живая масса суточных телят черно-рябой породы составляет 25,23±1,16кг к 30-суточному растет до 40,81±1,34, а суточный прирост достигает 412,7±7,1г. При этом, у суточных телят оказывается определенное количество Т-и В-лимфоцитов (табл. 34). Фагоцитарная активность лейкоцитов растет к 45,1±2,3%, а бактерицидная активность – 2,1±0,3 единиц. Следовательно, суточные животные имеют определенную систему иммунной защиты организма, которая еще не завершена и только частично отвечает на раздражители (табл. 35).
В становлении механизмов естественной резистентности поросят выделяют два периода: с первых по 20 и с 20 по 60 сутки жизни. В начале первого периода больше выражены клеточные факторы защиты. После приема молозива усиливается комплементсвязывающая и бактерицидная активность сыворотки крови. С 5 по 20 сутки жизни происходит последующее усовершенствование механизмов клеточной защиты. Доказано, что в конце первого периода начинается синтез -глобулинов.
Система специфической иммунной защиты имеет выраженную направленность против определенного антигена. Она уничтожает не только вредное начало, но и запоминает его и при повторном попадании реагирует на него быстро и специфически. Способность иммунной системы новорожденных отвечать на антигенную стимуляцию синтезом гуморальных антител проявляется не только с 7–14-суточного возраста у поросят и с 5-8-суточного возраста у телят, как указывают авторы [113, 114]. В-система иммунитета при рождении телят активизируется при действии стартового антигену молозива. Она особенно активизируется в 10-15-суточном возрасте. Этот период определяется как временный иммунодефицит. У телят первым синтезируется Ig М, который блокирует распространение возбудителя колибактериоза, но является малоэффективным против токсинов.
Следует отметить, что иммунная система достигает значительного развития у телят и поросят 2–3-месячного возраста. В организм новорожденных животных Ig поступают не только с молозивом (колостральный иммунитет), как отмечают исследователи, но и предопределены собственным синтезом. Присутствие незначительного количества Ig в сыворотке крови новорожденных к кормлению молозивом, предопределено собственным синтезом. Сравнительно высокая концентрация их может быть вызвана нарушением плацентарного барьера и фетальною инфекцией, которая негативно влияет на жизнеспособность новорожденных.
Молозиво содержит не меньше 60 мг/мл (6%) Ig. К защитным компонентам молозива относят также лизоцим, систему лактопероксидазы, комплемент, лимфоциты, нейтрофилы (в молозиве первого надоя их до 9% от общего количества лейкоцитов), моноциты (23,2%), лактоферин, Макрофаги и липиды.
Ig синтезируются плазматическими клетками (Z клетки), которые происходят от костно-мозговых В-клеток. В течение одной секунды они могут синтезировать до 1000 молекул Ig, которые появляются уже через 30 минут после контакта макрофагов с антигеном. Нагромождение иммуноглобулинов в секрете молочной железы коров начинается за пять недель до отела, а наиболее интенсивно – за 2-3 сутки. За это время из крови в молозиво поступает около 1,5 кг IGG [97]. Неправильное кормление приводит к снижению их количества.
До первого выпаивания молозива в сыворотке крови телят уровень Ig низкий (3,4–6,1 мг/мл IGG и 0,14–0,43 мл/мг IgМ), а сывороточные IgА и секреторный S IgА отсутствуют. Ig всасываются через эпителий в первые 24–36 часов жизни, поступая в лимфу и кровь. Максимальное содержание IGG регистрируется через 16-48, IgМ – 24-48 и IgА – 48 часов, при условии кормления молозивом через 2 часа после рождения. Через 8 часов после рождения интенсивность резорбции уменьшается в 2 раза и завершается через 20 часов (у отдельных животных – через 12 или 4–6 часов). Бактерии в желудке начинают размножаться через 1–2 часа после рождения. Задержка скармливания первого молозива предопределяет адгезии в кишечнике микроорганизмов, которые разрушают Ig.
Метод выпаивания молозива телят влияет на интенсивность усвоения Ig. Оптимальный метод – естественной. У 3 суточных телят, которые находились на подсосе в сыворотке крови количество Ig в два разы более высокая, Сравнительно с выпаиванием через сосковую поилку [97].
Высшая концентрация Ig у телят предопределена высокой резорбцией их в кишечнике. При выпаивании молозива из ведра или сосковой поилки разрыв между проявлением пищевого рефлекса достигает 4–6 часов, а при родах ночью – 8-10 часов, что уменьшает резорбцию Ig на 50-75%. Под коровой телята употребляют молозиво 5 раз, а в следующие трое суток – 6-8 раз, что отвечает его употреблению 7-8 или 10-12 литров. Присутствие коровы-матери повышает резорбцию Ig в кишечнике телят на 4–11%, на что также влияет температура молозива.
Интенсивность всасывания Ig в кишечнике новорожденных животных зависит от состояния энтероцитов, изменения которых предопределены дефицитом протеина и каротина в рационе коров, особенно в последние месяцы стельной. При дефицитном рационе коров на протеин (66% к потребности) в сыворотке крови телят содержание IGG составляло 11 мг/мл, IgА – 0,96 мг/мл, а IgМ – 0,90 мг/мл.
На абсорбцию молозивных Ig влияет низкий показатель рН крови и высокое содержание молочной и угольной кислот. Также негативно влияют тяжелые роды и внутриутробный ацидоз. У телят с рН крови 6,90–7,15 уровень Ig в суточном возрасте достигает 24,5 мг/мл, а при рН 7,35 – 37,9 мг/мл [97]. При низкой температуре воздуха (к –10о С) и высокой относительной влажности воздуха (65–78%) резорбция Ig значительно уменьшается.
Резорбция Ig в кишечнике новорожденных животных значительно уменьшается при высокой концентрации газов в помещении. Пренатальная недоразвитость негативно влияет не только на переваривание молозива, но и на резорбцию Ig.
У телят, которые своевременно получили качественное молозиво, максимальную концентрацию Ig в сыворотке крови определяют в первые двое суток после рождения (18-30 мг/мл). При этом наибольшая концентрация (до 82-84% от общего количества) приходится на IGG. Через 24-48 часов количество молозивных Ig постепенно уменьшается, а с 5-7 суток начинается синтез собственных Ig. Степень выраженности этого синтеза определяется уровнем молозивных Ig, периодом их полураспада, а также влиянием разных антигенов новорожденных. Следует помнить, что при высокой обеспеченности новорожденных Ig (больше 18 мг/мл в сыворотке крови) синтез их собственных антител начинается с суточного возраста и приобретает компетентность для защиты от инфекционных болезней в 1-3-месячном возрасте.
У телят лишенных молозива Ig М и Ig А оказываются лишь на 4-5, Ig G – на 8, а Ig G2 – на 32 сутки после рождения. Это свидетельствует о том, что организм новорожденных матуронатних животных, как зрелорождаемых, способный к собственному, но не совсем полному, антигенному ответу.
Гипогаммаглобулинемия (уменьшение Ig в сыворотке крови) до 20–40% новорожденных телят развивается в результате низкой резорбции молозивных Ig в результате нарушений внутриутробного развития органов пищеварения.
Низкий уровень Ig в крови 1–2 суточных животных является одной из причин массового заболевания эшерихиозом, рота - и коронавирусными энтеритами. Если концентрация Ig меньше 10 мг/мл в сыворотке крови, то заболеваемость телят достигает 100%, гибель составляет 50%. При содержании Ig 10-15 мг/мл гибель животных достигает 7–25%. Лишь при концентрации Ig больше 25 мг/мл телята после лечения выздоравливают [97]. По нашему мнению, концентрация Ig в крови телят также зависит от пренатального развития их собственных структур гемоиммунопоэза.
Защита организма новорожденных животных предопределяет также эпителий слизистой оболочки кишечника, слой гликопротеидного комплекса, кислотность желудочного содержания, активность ферментов пищеварения и факторы неспецифической защиты (лизоцим, лактоферин, комплемент, интерферон). В содержимом кишечника постоянно оказываются макрофаги, лимфоциты и нейтрофилы. В участках слизистой оболочки, где расположены кишечные бляшки, оказываются макрофаги, Т - и В-лимфоциты и плазматические клетки. Последние секретують IgА, который обеспечивает защиту энтероцитов от энтеропатогенных бактерий, которые имеют адгезивные свойства.
Кроме Ig, для предупреждения кишечно-желудочных заболеваний, большое значение имеют биологически активные вещества молозива (лизоцим, лактеин, лактотрансферин, комплемент), которые имеют бактериостатичные свойства при кислотности первой порции молозива 50-560 Т. Молозиво клинически здоровых коров имеет бактериостатические свойства касательно Escherichia coli, Staphyloccocus aureus и Salmonella enteritidis, которые препятствуют развитию энтеропатогенных микроорганизмов и стимулируют, этим самым, лимфоидную ткань кишечника.

